-
下列各组中的两种物质作用时,反应条件或反应物用量的改变对生成物没有影响的是
A. 碳与氧气 B. 氢氧化钠溶液与二氧化碳
C. 钠与氧气 D. 氢气与氯气
难度: 中等查看答案及解析
-
某二价金属的碳酸盐和碳酸氢盐的混合物与足量盐酸反应。消耗H+和产生CO2的物质的量之比为5:4,该混合物中碳酸盐和碳酸氢盐的物质的最之比为( )
A. 1:2 B. 2:3 C. 3:4 D. 4:5
难度: 简单查看答案及解析
-
疏松的糕点、饼干、面包等在制作过程中都使用了疏松剂。疏松剂受热分解,产生的气体使食品酥脆、松软。下列物质可作为食品制作过程中使用的疏松剂的是
A. NaCl B. Na2CO3 C. NaHCO3 D. NaOH
难度: 中等查看答案及解析
-
过氧化钠具有强氧化性,遇木炭、铝粉等还原性物质时可燃烧。下列有关说法不正确的是( )
A. Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂
B. 1mol过氧化钠中阴离子数目为NA
C. 过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性
D. 过氧化钠与二氧化硫反应时可生成硫酸钠
难度: 中等查看答案及解析
-
下列物质之间进行反应时,可用离子方程式2H+ + CO32- → H2O+CO2 ↑表示的是
A. 碳酸钠溶液中加入足量醋酸溶液 B. 碳酸钡和稀硝酸反应
C. 碳酸氢钠溶液中加入少量稀硫酸 D. 在盐酸溶液中滴入少量碳酸钾溶液
难度: 中等查看答案及解析
-
下列分散系不能发生丁达尔现象的是
A. 蔗糖溶液 B. 牛奶 C. 豆浆 D. 烟、云、雾
难度: 简单查看答案及解析
-
下列说法正确的是
A. 单位体积溶液里所含的溶质的物质的量,叫做物质的量浓度
B. 气体摩尔体积就是22.4 L /mol
C. 摩尔质量就是微粒的相对分子质量或者相对原子质量
D. 物质的量就是物质的质量
难度: 简单查看答案及解析
-
玻璃器皿上沾有一些用水洗不掉的残留物,其洗涤方法正确的是( )
①残留在试管内壁上的碘,用酒精洗涤
②盛放过苯酚的试剂瓶中残留的苯酚,用酒精洗涤
③ 做银镜反应后试管壁上银镜,用稀氨水洗涤
④ 沾附在试管内壁上的油脂,用热碱液洗涤
A、①②④ B、②③④ C、①③④ D、①②③④
难度: 简单查看答案及解析
-
某混合溶液中所含离子的浓度如下表,则M离子可能为
所含离子
Cl-
SO42-
H+
M
浓度/(mol·L-1)
2
1
2
1
A. Na+ B. Ba2+ C. NO3- D. Mg2+
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 同温同压下,相同体积的物质,它们的物质的量必相等
B. 任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C. 1L一氧化碳气体一定比1L氧气的质量小
D. 等体积、等物质的量浓度的强酸中所含的H+数一定相等
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A. 1 mol NH3所含有的原子数为NA
B. 将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒的数目为0.01NA
C. 常温常压下,48gO2和O3的混和物中所含氧原子数为3NA
D. 1L 0.1 mol·L-1 NaCl溶液中所含的Na+为NA
难度: 中等查看答案及解析
-
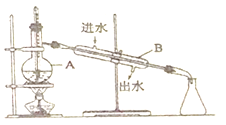
实验室制取少量干燥的氨气涉及下列装置,其中正确的是

A. ①是氨气发生装置 B. ②是氨气吸收装置
C. ③是氨气发生装置 D. ④是氨气收 集、检验装置
难度: 中等查看答案及解析
-
现有三组混合液:①汽油和水;② 75%的酒精溶液;③碘的水溶液,分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 分液、蒸馏、萃取
C. 萃取、蒸馏、分液 D. 蒸馏、萃取、分液
难度: 简单查看答案及解析
-
下列有关物质分类正确的是
①混合物:盐酸、王水、水玻璃、水银
②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:H2SO4、胆矾、冰醋酸、硫酸钡
④同素异形体:C60、C70、金刚石、石墨.
A. ①③ B. ②④ C. ②③ D. ③④
难度: 简单查看答案及解析
-
工业上通过2Al2O3+3C+6Cl2═4AlCl3+3CO2制取无水氯化铝,下列说法正确的是
A. AlCl3是氧化产物 B. Cl2是氧化剂
C. 每生成1 mol CO2 , 转移4个电子 D. C发生还原反应
难度: 中等查看答案及解析
-
已知Iˉ、Fe2+、SO2、Clˉ、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Clˉ< Fe2+< H2O2< Iˉ< SO2。则下列反应不能发生的是
A. 2Fe3++SO2+2H2O=2Fe2++SO42ˉ+4H+ B. Cl2+SO2+2H2O=H2SO4+2HCl
C. H2O2+2H++ SO42ˉ=SO2↑+O2↑+2H2O D. 2Iˉ+2H++H2O2=2H2O+I2
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B. 硫酸亚铁溶液中加入过氧化氢溶液Fe2++2H2O2+4H+=Fe3++4H2O
C. 用氨水吸收少量二氧化硫OH-+SO2=HSO3-
D. 硝酸铁溶液加入过量氨水3NH3·H2O+Fe3+=Fe(OH)3↓+3NH4+
难度: 简单查看答案及解析
-
以下说法正确的是
A. 物质所含元素化合价升高的反应叫还原反应
B. 在氧化还原反应中,失去电子的元素化合价降低
C. 物质中某元素失去电子,则此物质是氧化剂
D. 还原剂中必定有一种元素被氧化
难度: 中等查看答案及解析
-
向FeI2溶液中滴加适量氯水,将反应后溶液分3份,甲试管中滴加淀粉溶液,乙试管滴加KSCN溶液,丙试管中滴加酸性高锰酸钾溶液,下列说法正确的是
A. 若甲试管溶液呈蓝色,则乙试管溶液一定呈血红色
B. 若甲试管溶液呈蓝色,则乙试管溶液可能无明显现象
C. 乙试管溶液呈血红色,则甲试管溶液不可能呈蓝色
D. 甲试管溶液呈蓝色,丙试管中紫红色褪去,说明滴加氯水后的溶液中一定存在Fe3+和Fe2+
难度: 中等查看答案及解析
-
已知X2、Y2、Z2、W2四种单质,已知它们能发生如下反应:①X2+2NaY=Y2+2NaX ②Z2+2NaX=X2+2NaZ ③W2+2NaZ=Z2+2NaW,下列说法中不正确的是
A. Z2与Y-在水溶液中不能大量共存
B. 还原性: Y- >Z- >W-
C. 2NaW+Y2=2NaY+W2
D. W2通入到NaX和NaY的混合溶液中: W2优先氧化Y-
难度: 中等查看答案及解析
-
证明某溶液中只含有Fe2+而不含有Fe3+的实验操作是
A. 先滴加氯水,再滴加KSCN溶液后显红色
B. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C. 滴加NaOH溶液,产生红褐色沉淀
D. 滴加KSCN溶液,溶液呈红色,再加足量铁粉红色消失
难度: 中等查看答案及解析
-
等质量的两块钠,第一块在加热下与足量氧气充分反应,第二块在常温下与足量氧气充分反应。则下列说法正确的是
①两块钠失去电子一样多 ②第一块钠失去电子多 ③第二块钠失去电子多
④两块钠的反应产物质量一样大 ⑤第一块钠的反应产物质量大 ⑥第二块钠的反应产物质量大
A. ①④ B. ②⑤ C. ③⑥ D. ①⑤
难度: 中等查看答案及解析