-
中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
选项
古诗文
化学知识
A
《本草经集注》中记载鉴别硝石(KNO3)和朴硝(Na2SO4)的方法。“强烧之,紫青烟起,云是真硝石也。”
利用焰色反应
B
《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛”
强水为氢氟酸
C
《诗经·大雅·绵》:“堇茶如饴。”郑玄笺:“其所生菜,虽有性苦者,甘如饴也。”
糖类均有甜味
D
《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”
铁的合金硬度比纯铁的大,熔点比纯铁的高
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
2018 年全国生态环境保护大会在北京召开,旨在保护环境、造福人类。下列有关说法正确的是
A. 绿色化学的核心是应用化学原理对环境污染进行治理
B. 用光催化分解代替电解水制氢气,可实现节能环保
C. 天然气、沼气和太阳能分别属于化石能源、可再生能源和二次能源
D. “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述一定正确的是
A. 0.1mol苯完全转化为环己烷,破坏的碳碳双键总数为0.3NA
B. 1mol·L-1的CH 3COONH4溶液中含有的氧原子总数大于2NA
C. 4.6g钠用有小孔的铝箔包裹后与足量水充分反应生成H2的分子总数为0.1NA
D. 标准状况下,2.24L由CO和N2成的混合气体中含有的原子总数为0.2NA
难度: 中等查看答案及解析
-
已知a、b、c的分子式均为C4H8O2,其结构简式如下图所示,下列说法正确的是
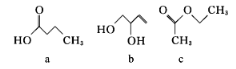
A. a、b均能使酸性KMnO4溶液褪色 B. a、b、c均可与氢氧化钠溶液反应
C. a、b、c中只有b的所有原子处于同一平面 D. c的二氯代物有六种(不考虑立体异构)
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是
A. 核内质子数为117、中子数为174的核素Ts可表示为:
B. 甲烷分子的比例模型:
C. COCl2的结构式为:
D. H2O2的电子式为:H+[
]2-H+
难度: 简单查看答案及解析
-
某工业废气中的SO2经如图中的两个循环可分别得到S和H2SO4。下列说法正确的是
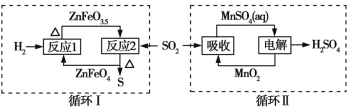
A. 循环Ⅰ中,反应1中的氧化产物为ZnFeO3.5
B. 循环Ⅰ中,反应2中的还原产物为ZnFeO4
C. Mn可作为循环Ⅱ中电解过程中的阳极材料
D. 循环Ⅰ和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的质量之比为16∶49
难度: 中等查看答案及解析
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )

A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含极性共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
难度: 中等查看答案及解析
-
实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是
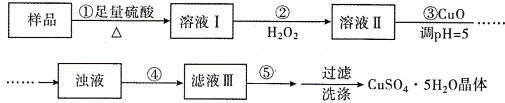
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤④为过滤,步骤⑤蒸发结晶
难度: 中等查看答案及解析
-
下列叙述或书写正确的是
A. H2(g)+F2 (g)===2HF(g) △H=-270 kJ·mol -1,则相同条件下,2mol HF气体的能量大于1mol氢气和1mol氟气的能量之和
B. 2H2(g)+O2(g)===2H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热大于241.8kJ.mol-1
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该中和反应的热化学方程式为NaOH+HCl===NaCl+H2O △H =-57.4kJ·mol-1
D. 500℃、30MPa时,发生反应N2(g)+3H2(g)
2NH3(g) △H =-38.6kJ·mol-1在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. Na2S2O3溶液与稀H2SO4反应的离子方程式:S2O32- + 6H+ =2S↓ +3H2O
B. 向饱和Na2CO3溶液中通入过量CO2,2Na+ + CO32-+CO2+H2O═2 NaHCO3↓
C. Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时,Fe+NO3-+4H+═Fe3++NO↑+2H2O
D. Ba(OH)2与等物质的量 NaHSO4混合:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
难度: 中等查看答案及解析
-
已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是( )
A. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
B. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡: NH4HSO4(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
难度: 中等查看答案及解析
-
装置(1)为铁镍(Fe-Ni)可充电电池:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,电极Y附近溶液先变红。下列说法正确的是

A. 闭合开关K时,电极X的电极反应式为2H++2e-===H2↑
B. 闭合开关K时,电极A的电极反应式为Ni2O3+2e-+2H++H2O===2Ni(OH)2
C. 给装置(I)充电时,电极B上参与反应的物质被氧化
D. 给装置(I)充电时,OH通过阴离子交换膜移向电极A
难度: 中等查看答案及解析
-
下列实验的操作、现象与对应结论均正确的是
选项
操作
现象
结论
A
向 AgCl 悬浊液中滴加几滴 NaI 溶
液
出现黄色沉
淀
Ksp(AgCl)>Ksp(AgI)
B
将溴乙烷与 NaOH 乙醇溶液共热逸
出气体通入到酸性 KMnO4 溶液中
KMnO4 溶液
紫红色褪去
溴乙烷与 NaOH 乙醇溶液共热
产生了乙烯
C.
向待测液中依次滴入氯水和 KSCN
溶液
溶液变为红
色
待测溶液中含有 Fe2+
D
将水蒸气通过灼热的铁粉
粉末变红
铁与水在高温下发生反应生成
了三氧化二铁
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
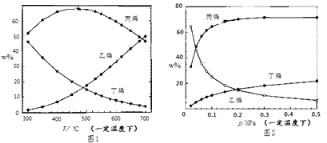
碳酸二甲酯(CH3OCOOCH3,简称 DMC)是一种应用前景广泛的新材料。在密闭容器中按n(CH3OH)∶n(CO2)=2∶1 投料直接合成 DMC,反应方程式为﹕2CH3OH(g)+CO2(g)
CH3OCOOCH3(g)+H2O(g)。一定条件下, 平衡时 CO2 的转化率如图所示。下列说法中不正确的是
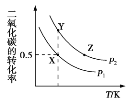
A. 该反应的正反应为放热反应
B. 压强 p2>p1
C. X 点对应的平衡常数为 0.1L/mol
D. X、Y、Z 三点对应的初始反应速率的关系为 Z> Y > X
难度: 中等查看答案及解析
-
将15.2 g 铜和镁组成的混合物加入250 mL4.0 mol • L-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0 L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法不正确的是
A. 原固体混合物中,Cu和Mg的物质的量之比为2:1
B. 氢氧化钠溶液的浓度为0.8 mol·L-1
C. 固体溶解后的溶液中硝酸的物质的量为0.1mol
D. 生成的NO气体在标况下的体积为4.48L
难度: 中等查看答案及解析
-
25℃时,向20mL0.1mol·L-1四氯金酸( HAuCl4)溶液中滴加0.1mol·L-1NaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法不正确的是

A. b点溶液中存在关系:2c(H+)+ c(HAuCl4)=2c(OH-)+ c(AuCl4-)
B. X点描述的是滴定曲线中b点含氯微粒的物质的量分数δ与pH的关系
C. c点溶液中存在关系:c(Na+)=c(AuCl4-)
D. d点时,溶液中微粒浓度的大小关系为c(Na+)>c(AuCl4-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
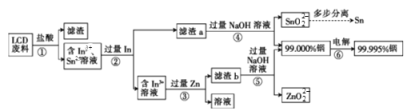

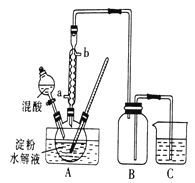
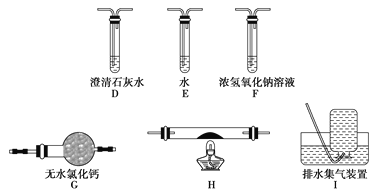
 ___H2C2O4+9NO2↑+3NO↑+_______ ______
___H2C2O4+9NO2↑+3NO↑+_______ ______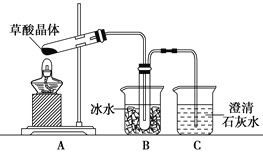
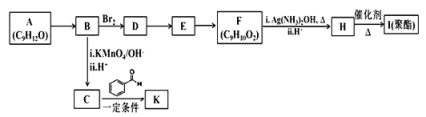

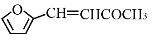 )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(