-
下列关于能源和作为能源的物质叙述错误的是 ( )
A. 化石能源物质内部蕴涵着大量的能量
B. 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C. 物质的化学能可以在不同的条件下转化为热能、电能被人类利用
D. 吸热反应没有利用价值
难度: 简单查看答案及解析
-
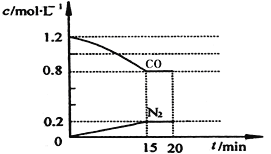
已知CH4的燃烧热是akJ/mol,由CH4、H2按3︰1比例组成的混合物2mol,完全燃烧并恢复到常温吋,放出的热量为bkJ,则H2的燃烧热为(kJ/mol)为( )
A. 2b-3a B. 3a-2b C.
(2b-3a) D.
(a-2b)
难度: 困难查看答案及解析
-
下列选项与盐类水解无关的是( )
A. 泡沫灭火器的反应原理
B. 氯化铁溶液刻制印刷电路板
C. 氯化铵溶液除铁锈
D. 醋酸铵溶液显中性
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A. 纯碱溶液中:Al3+、Ba2+、Cl-、NO3-
B. 室温下,pH=1的溶液中:K+、Fe2+、MnO4-、I-
C. 能使甲基橙变为黄色的溶液中:Na+、Al3+、Cl-
D. 室温下,
=1×10-12的溶液中:K+、Na+、CO3-、NO3-
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是 ( )
A. 10g46%的乙醇水溶液中所含氢原子数目为1.2NA
B. 1L1mol/L Na2CO3溶液中含有NA个CO32-
C. 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
D. 常温下pH=1的H2SO4溶液中,H+的浓度为0.20mol/L
难度: 困难查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) △H<0,下列研究目的和示意图相符的是
A
B
C
D
研究
目的压强对反应的影响(P2>P1)
温度对反应的影响
平衡体系增加N2对反应的影响
催化剂对反应的影响
图示

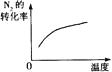

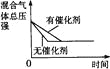
难度: 中等查看答案及解析
-
铁镍可充电电池以KOH溶液为电解液,放电时的总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法正确的是( )
A. 放电时,K+向Fe电极迁移
B. 放电时,正极反应式为Fe-2e-+2OH-=Fe(OH)2
C. 充电时,阴极附近溶液的pH增大
D. 充电时,阴极反应式为2Ni(OH)2-2e-+2OH-=Ni2O3+3H2O
难度: 中等查看答案及解析
-
下列有关说法正确的是 ( )
A. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B. 所有的化学反应都需要一定的活化能来推动
C. CH3COOH 溶液加水稀释后,溶液中
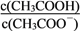 的值增大
的值增大D. Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小
难度: 中等查看答案及解析
-
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A. 反应混合物的浓度 B. 反应物的转化率
C. 正、逆反应的速率 D. 反应体系的压强
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是 ( )
A. 向K2Cr2O4溶液中滴入浓的NaOH溶液后,溶液黄色加深
B. 实验室用排饱和食盐水法收集氯气
C. 反应2SO2+O2
2SO3 ΔH<0,工业上采取高温的措施有利于提高SO2的转化率
D. 合成氨反应:N2+3H2
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
难度: 中等查看答案及解析
-
下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
难度: 中等查看答案及解析
-
一定量的锌粉和6 mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2总量的是 ( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A. ①③④ B. ①③⑤ C. ②④⑤ D. ②③⑤
难度: 中等查看答案及解析
-
现有两瓶浓度相同的失去标签的Na2CO3和NaHCO3的无色饱和溶液,有同学提出简便的鉴別方法,其中不合理的是 ( )
①用干燥的pH试纸检验,pH大的是Na2CO3
②取同量的溶液于两支试管中,各滴入酚酞溶液,红色较深的是Na2CO3
③取同量的溶液于两支试管中,加热.有气泡产生的是NaHCO3
④取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3
⑤取同量的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3
⑥取同量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3,
A. ①② B. ③⑥ C. ④⑤ D. ②⑤.
难度: 中等查看答案及解析
-
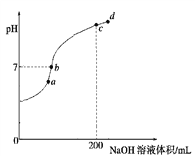
常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L CH3COOH溶液所得滴
定曲线如图。下列说法不正确的是

A. a点所示溶液中:c(Na+)=c(CH3COOH) + c(CH3COO-)
B. b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-)
C. d点所示溶液中:c(Na+) >c(CH3COO-) >c(OH-) >c(H+)
D. 滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) >c(H+)> c(Na+)>c(OH-)
难度: 中等查看答案及解析
-
25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是( )
弱酸
CH3COOH
HCN
H2CO3
Ka
1.8×10-5
4.9×10-10
K1=4.3×10-7 K2=5.6×10-11
A. 0.1 mol/L 的CH3COOH的 pH比0.1mol/L HCN的pH大
B. 等物质的量浓度溶液pH关系:pH(CH3COONa)<pH(NaHCO3) <pH(NaCN)
C. 向NaCN溶液中通入少量CO2: CO2 + H2O + 2NaCN == 2HCN + Na2CO3
D. NaHCO3和Na2CO3的混合液中:c(Na+) +c(H+)=c(OH-)+ c(HCO3-)+c(CO32-)
难度: 中等查看答案及解析
-
一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列有关判断不正确的是 ( )
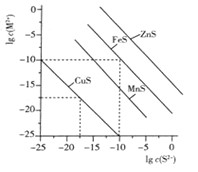
A. 该温度下,Ksp(MnS)大于1.0×10-35
B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀
C. 向c(Fe2+)=0.1mol·L-1的溶液中加入CuS粉末,有FeS沉淀析出
D. 该温度下,溶解度:CuS>MnS>FeS>ZnS
难度: 困难查看答案及解析
-
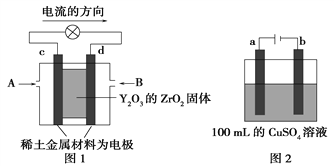
常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是 ( )

A. t1时刻前,A1片的电极反应为:2A1+3H2O - 6e- ═ A12O3+6H+
B. t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应
C. t1之后,负极Cu失电子,电流方向发生改变
D. 烧杯中发生的离子反应为:2NO2+2OH- ═ 2NO3-+H2O
难度: 困难查看答案及解析
-
已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如下图所示。计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀。下列说法正确的是 ( )
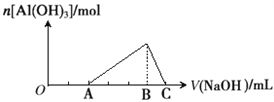
A. 原混合溶液中c(Fe3+):c(Al3+)=1:1
B. Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去
C. B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104
D. C点溶液中的溶质只有NaAlO2
难度: 困难查看答案及解析
-
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是 ( )
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
难度: 中等查看答案及解析
-
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下,已知转化过程中的反应为2CrO42﹣(aq)+2H+(aq)
Cr2O72﹣(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是 ( )
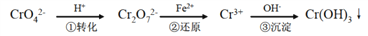
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要917.4 g
C. 常温下转化反应的平衡常数K=l×1014.则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
难度: 极难查看答案及解析