-
已知:25 ℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断正确的是
A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C. 25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L的氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
D. 25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
难度: 中等查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
A. 检测时,电解质溶液中的H+向负极移动
B. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C. 电池反应的化学方程式为:CH3CH2OH + O2= CH3COOH + H2O
D. 正极上发生的反应为:O2+ 4e-+ 2H2O = 4OH-
难度: 中等查看答案及解析
-
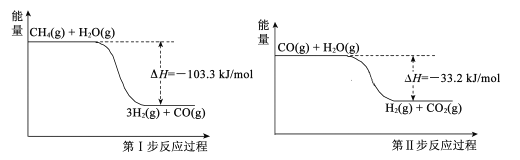
京津冀地区的 大气污染问题已成影响华北环境的重要因素,有人想利用下列反应:2CO(g)+SO2(g)
2CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1 来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是 ( )
A.
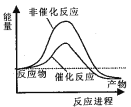 B.
B. 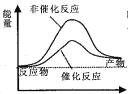 C.
C. 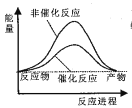 D.
D. 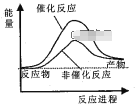 D
D难度: 中等查看答案及解析
-
1.0 mol.L-1 的氨水中存在下列平衡:NH3·H2O
NH4++OH-,若想增大NH4+的浓度, 而不增大OH-的浓度,应采取的措施是 ( )
A. 适当升高温度 B. 加入NaOH固体
C. 通入NH3 D. 加入NH4Cl固体
难度: 简单查看答案及解析
-
以下事实不能用勒夏特利原理来解释的是: ( )
A. 用排饱和食盐水的方法收集氯气
B. 增大压强,有利于N2和H2反应生成NH3
C. 合成氨工业选择高温(合成氨反应为放热反应)
D. 在Fe3++3SCN -
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行
B. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57 kJ·mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
难度: 简单查看答案及解析
-
反应 H2(g) + I2(g)
2HI(g) 的平衡常数K1 ,反应 HI(g)
1/2H2(g)+1/2 I2(g)的平衡常数K2 ,则K1、K2的关系为(平衡常数为同温度下的测定值) ( )
A. K1=2K2 B. K1=K22 C. K1=
K2 D. K1=
难度: 中等查看答案及解析
-
一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)
2Z(g) 一定达到化学平衡状态的是
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成2n mol Z,同时消耗2n mol Y
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
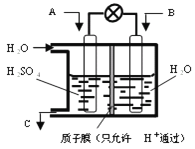
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+
Fe2++Cr3+。下列说法一定正确的是
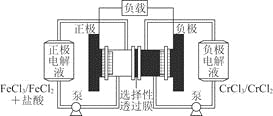
A. 充电时,阴极的电极反应式为Cr3++e-=Cr2+
B. 电池放电时,负极的电极反应式为Fe2+-e-=Fe3+
C. 电池放电时,Cl-从负极室穿过选择性透过膜移向正极室
D. 放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
难度: 中等查看答案及解析
-
A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)
zC(g) △H<0。达到化学平衡后测得A的浓度为0.5 mol·L-1;在恒温下,将密闭容器的容积压缩至原来的二分之一,再次达到平衡时,测得A的浓度为0.9 mol·L-1。则下列叙述中正确的是 ( )
A. x+y<z B. 平衡向正反应方向移动了
C. B的转化率下降 D. C的体积分数减小
难度: 中等查看答案及解析
-
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 2B(g)
xC(g)ΔH=-192kJ·mol-1。向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
难度: 中等查看答案及解析
-
将 lmolSO2和 l mol O2通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时 SO3为0.3mol,若此时移走 0.5mol O2和 0.5mol SO2则反应达到新的平衡时,SO3的物质的量是
A. 0.3mol B. 0.15mol
C. 小于 0.15mol D. 大于0.15mol而小于 0.3mol
难度: 中等查看答案及解析
-
已知:HCN(aq)+ NaOH(aq) ==NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq) ==NaCl (aq)+H2O(l) ΔH=-55.6 kJ·mol-1
则HCN在水溶液中电离的ΔH等于
A.+43.5 kJ·mol-1 B .+67.7 kJ·mol-1
C.-43.5 kJ·mol-1 D.-67.7 kJ·mol-1
难度: 中等查看答案及解析
-
某无色透明溶液含有下列离子中的几种: Mg2+、 Cu2+、 Ba2+、 H+、 SO42-、OH-、 NO3-、 HCO3-,在其中加入金属铁,发生反应放出气体只有H2, 试 判断上述离子中 一定不能 大量存在于此溶液中的有
A. 2种 B. 5种 C. 4种 D. 6种
难度: 中等查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数
(25℃)Ki=1.77×10-4
Ki=4.9×10-10
Ki1=4.3×10-7
Ki2=5.6×10-11下列选项错误的是
A. 2CN-+H2O+CO2→2HCN+CO32-
B. 2HCOOH+CO32-→2HCOO-+H2O+CO2↑
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
难度: 中等查看答案及解析