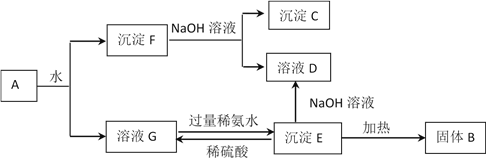
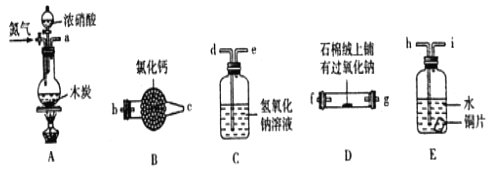
-
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,下表为四种金属的熔、沸点。
| Na | Cu | Al | Fe |
| 熔点(℃) | 97.5 | 1 083 | 660 | 1 535 |
| 沸点(℃) | 883 | 2 595 | 2 200 | 3 000 |
根据以上数据判断其中不能形成合金的是
A. Cu和Al B. Fe和Cu C. Fe和Na D. Al和Na
-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 | 现象或事实 | 解释 |
| A | 用热的烧碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
-
高铁酸钾(K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
A. 有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B. 有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C. 有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D. 有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
-
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
A. 若无固体剩余,则溶液中一定有Fe3+
B. 若有固体存在,则溶液中一定有Fe2+
C. 若溶液中有Cu2+,则一定没有固体析出
D. 若溶液中有Fe2+,则一定有Cu析出
-
下列实验操作正确的是
| 选项 | 实验 | 操作 |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下黄豆大小的钠,小心放入装满水的烧杯中 |
| B | 检验NaHCO3与Na2CO3溶液 | 用小试管分别取少量溶液,然后滴加澄清石灰水 |
| C | 证明Na2O2与CO2是放热反应 | Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应 |
| D | 检验Na2CO3与K2CO3溶液 | 用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,直接观察火焰的颜色 |
A. A B. B C. C D. D
-
化学与社会、生活密切相关。下列说法正确的是( )
A. 在食品袋中放入盛有硅胶的透气小袋可防止食品因氧化而变质
B. 燃烧煤、天然气、石油等排放的大量CO2是导致雾霾的原因
C. 小苏打能做糕点的膨松剂是由于NaHCO3能与碱反应
D. 漂白精可用作消毒剂是由于Ca(ClO)2可转化为HClO
-
下列类比关系正确的是 ( )。
A. AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3·H2O也生成AlO2-
B. Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
C. Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D. Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
-
下列物质与水作用形成的溶液能与NH4Cl反应生成NH3的是
A. 二氧化氮 B. 钠 C. 硫酸镁 D. 二氧化硅
-
下列关于Na2O2的叙述不正确的是( )
A.1 mol Na2O2与足量CO2反应转移的电子为1 mol
B.将10 g H2和CO的混合气体充分燃烧,将生成物(H2O、CO2)通入足量的Na2O2固体中充分反应,固体增重为10 g
C.将Na2O2投入FeSO4溶液中生成红褐色沉淀
D.将等物质的量的NaHCO3和Na2O2混合后,在密闭容器中充分加热排除气体后剩余固体为Na2CO3
-
将铝、铁物质的量均为0.2mol的某种铝铁合金粉末分别于下列溶液充分反应(溶液均过量),放出氢气最多的是
A.18.4mol·L-1H2SO4溶液
B.1.5mol·L-1 HCl溶液
C.4mol·L-1 HNO3溶液
D.3mol·L-1 NaOH溶液
-
在无色透明的溶液中能大量共存的一组离子是 ( )
A. H+、Na+、SO42-、Cl-
B. Ba2+、NH4+、OH-、MnO4-
C. Al3+、H+、ClO— 、Br—
D. H+、Fe2+、SO42-、Cl-
-
某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比是
A. 1:1 B. 2:1 C. 3:2 D. 4:1
-
在我国近年来报道的高温超导体中,铊(Tl)是组成成分之一。已知铊和铝是同族元素,关于铊的性质的推断可能错误的是 ( )
A. 是银白色的软质金属 B. 能生成+3价的离子化合物
C. 与硝酸作用能放出氢气并生成硝酸盐 D. 铊的金属性强于铝
-
下列各物质中,不能由化合反应得到的是 ( )
A.FeCl3 B.FeCl2 C.Fe(OH)3 D.H2SiO3
-
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B.常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数为3NA
C.0.1 mol·L-1 NaF溶液中,HF和F-总和为0.1NA个
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
-
用铝热法还原下列化合物,制得金属1mol,消耗铝最少的是( )
A. MnO2 B. WO3 C. Co3O4 D. Cr2O3
-
下列离子方程式正确的是 ( )
A. 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B. 硫酸钠与氯化钡两溶液混合:SO42-+Ba2+=BaSO4↓
C. 铁和稀盐酸反应:2Fe+6H+==2Fe3++3H2↑
D. 氧化铜与硫酸混合:Cu2++SO42-=CuSO4