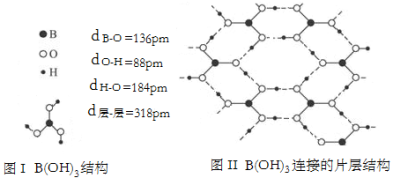
-
下列仪器对应的名称正确的是




A.三脚架 B.酸式滴定管 C.长颈漏斗 D.蒸发皿
难度: 简单查看答案及解析
-
易燃易爆有毒的化学物质在其包装上应贴上危险警告标签。下列物质贴错了标签的是
A
B
C
D
物质的化学式
浓H2SO4
CCl4
P4
NH4NO3
危险警告标签
腐蚀品
易燃品
剧毒品
爆炸品
难度: 简单查看答案及解析
-
下列说法正确的是
A.烧瓶、锥形瓶、蒸发皿加热时均需要垫上石棉网
B.分液漏斗、滴定管、容量瓶使用前均需要检查是否漏水
C.配制1 mol·L-1 NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒
D.乙酸乙酯、硝基苯的制备、银镜反应实验均需要水浴加热
难度: 简单查看答案及解析
-
下列实验操作或对实验事实的叙述不正确的是
A.取用钠、钾、白磷时,没用完的药品要放回原瓶
B.用pH试纸测得氯水的pH为2
C.氯水、硝酸银溶液存放在配有磨口塞的棕色细口瓶中
D.金属钠着火时,用细沙覆盖灭火
难度: 简单查看答案及解析
-
下列有关物质的分类或归类正确的是
A.化合物:CaCl2、烧碱、聚乙烯、HD
B.酸性氧化物:SO2、NO、CO2、Mn2O7
C.胶体:雾、牛奶、豆浆、烟水晶
D.同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
难度: 中等查看答案及解析
-
“纳米技术”广泛应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳
米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是
A.能全部通过半透膜 B.能发生丁达尔现象
C.一定能导电 D.一定为悬浊液或乳浊液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1.0L 1.0mol·L-1 CH3COOH溶液中,CH3COOH分子数为NA
B.7.8g Na2S与Na2O2的混合物中阴离子数大于0.1NA
C.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
D.标准状况下,含有lmol硫原子的SO2与SO3的混合物,其体积小于22.4L
难度: 中等查看答案及解析
-
下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.电解质溶液的导电过程实质上是电解过程,是化学变化
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.Cl2、SO2的水溶液能导电,是电解质
难度: 中等查看答案及解析
-
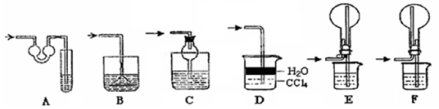
下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是
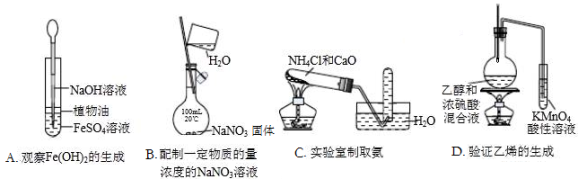
难度: 中等查看答案及解析
-
下列溶液中氯离子的物质的量浓度与50mL 1mol•L-1氯化铝溶液中氯离子的物质的量浓度相等的是
A.150mL 1mol•L-1氯化钠溶液
B.75mL 1.5mol•L-1氯化钙溶液
C.150mL 3mol•L-1氯酸钾溶液
D.50mL 1mol•L-1氯化镁溶液
难度: 中等查看答案及解析
-
下列有关溶液的说法正确的是
A.要配制浓度为0.25mol·L-1的NaOH溶液480mL,应称量4.8g NaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容
B.配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低
C.配制一定物质的量浓度的溶液定容时,俯视刻度线导致所配浓度偏高
D.配制20g密度为ρg·cm-3的Ca(NO3)2溶液中含有2g Ca(NO3)2,则溶液中NO3-的物质的量浓度为5ρ/41mol·L-1
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是
选项
叙述Ⅰ
叙述Ⅱ
A
KNO3的溶解度大
用重结晶法除去KNO3中混有的NaCl
B
BaSO4难溶于酸
用盐酸和BaCl2溶液检测SO42-
C
NH3能使酚酞溶液变红
NH3可用于设计喷泉实验
D
Ca(OH)2能制成澄清石灰水
可配制2.0 mol·L-1的Ca(OH)2溶液
难度: 中等查看答案及解析
-
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x。则
表示的是
A.V L该气体的质量(以g为单位) B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位) D.1 L该气体中所含的分子数
难度: 困难查看答案及解析
-
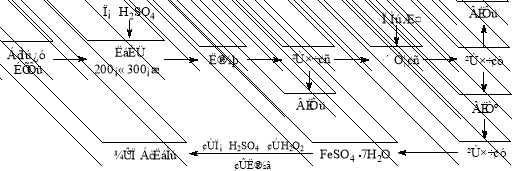
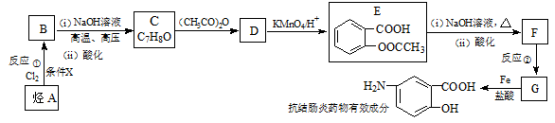
有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是
途径①:
途径②:
A.途径①反应中体现了浓硝酸的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2浓度来提高产率
C.由途径①和②分别制取1mol H2SO4,理论上各消耗1mol S,各转移6mol电子
D.途径②与途径①相比更能体现“绿色化学”理念,是因为途径②比途径①污染相对小且原子利用率高
难度: 困难查看答案及解析
-
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg·cm-3。下列说法错误的是
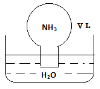
A.水最终会充满整个烧瓶
B.所得溶液的物质的量浓度为1/22.4 mol·L-1
C.所得溶液的质量分数为17/22400ρ
D.所得溶液中,n(NH3·H2O)+n(NH4+)=V/22.4 mol
难度: 中等查看答案及解析
-
据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt的化合价为+5,对于此反应,下列说法正确的是
A.O2 是氧化剂,PtF6 是还原剂
B.O2(PtF6)中氧元素的化合价为+1
C.O2(PtF 6)中不存在共价键
D.每生成1mol O2(PtF6)则转移1mol电子
难度: 困难查看答案及解析
-
下列离子方程式正确的是
A.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH+Al3++2SO+2Ba2++5OH-=AlO+2BaSO4↓+NH3·H2O+2H2O
B.工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+ H2O
C.制备Fe(OH)3胶体: Fe3++3H2O
Fe(OH)3(胶体)+3H+
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
难度: 困难查看答案及解析
-
已知Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是
A.Al2S3、FeS和S B.Fe(OH)3和Al(OH)3
C.Fe2S3和 Al(OH)3 D.FeS、Al(OH)3和S
难度: 困难查看答案及解析
-
在指定环境中,下列各组离子一定可以大量共存的是
A.25℃,
的溶液中:ClO-、Cl-、K+、HSO3-
B.无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4] 2+
C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42-
D.加入Al能放出H2的溶液中:NH4+,SO42-,Br-, NO3-
难度: 困难查看答案及解析
-
根据表中信息判断,下列选项正确的是
序号
反应物
产物
①
KMnO4、H2O2、H2SO4
K2SO4……
②
C12、FeBr2
FeC13、FeBr3
③
MnO4-……
C12、Mn2+……
A.第①组反应的其余产物为H2O、MnSO4
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成lmol Cl2,转移电子5mol
D.氧化性由强到弱顺序为MnO4一>Cl2> Fe3+> Br2
难度: 困难查看答案及解析
-
如图中的两条线分别代表的是:1g C3H6 和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体可能是
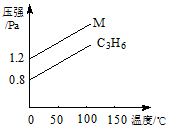
A.C2H4 B.C3H8 C.H2S D.N2O4
难度: 困难查看答案及解析
-
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+ cCl2↑+ d HClO4 +eH2O。下列有关说法不正确的是
A.还原产物只有Cl2
B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:
3HClO3 =2O2↑+ C12↑+ HClO4 + H2O
C.由非金属性Cl>S,可推知酸性HClO3>H2SO4
D.若化学计量数a=8,b=3,则该反应转移电子数为20
难度: 困难查看答案及解析
-
将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量不可能为5 g
B.参加反应的硝酸的物质的量为0.1 mol
C.沉淀完全时消耗NaOH溶液的体积为150 mL
D.溶解合金时收集到NO气体的体积在标准状况下约为2.24 L
难度: 简单查看答案及解析
-
已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2 ,下列关于该反应的叙述不正确的是
A.该反应中,氧化剂与还原剂物质的量之比为9:5
B.当反应中有1mol电子转移时,被还原氯气物质的量为1/18 mol
C.每产生1mol O2时,被氧元素还原的氯气物质的量为2mol
D.参加反应的水有2/5被氧化
难度: 中等查看答案及解析
-
一定体积的酸性KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.2000 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
A.0.0176 B.0.1600 C.0.1200 D.0.2400
难度: 中等查看答案及解析