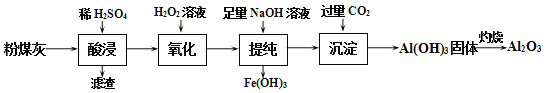
-
化学与生活密切相关,下列说法正确的是
A. 硅酸钙可用于生产黏合剂和防火剂
B. 改燃煤为燃气,可以减少废气中SO2等有害物质的排放量
C. 合成纤维、人造纤维及碳纤维都属于有机高分子材料
D. 发泡塑料饭盒适用于微波炉加热食品,不适于盛放含油较多的食品
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
B. 1mol硝基(-NO2)与46g二氧化氮所含的电子数均为23NA
C. 16.2g14C10H22中含有的共价键数目为3.2NA
D. 向含1molFeI2的溶液中通入1molCl2充分反应,该反应转移电子数为3NA
难度: 中等查看答案及解析
-
下列各组离子能大量共存,且当加入试剂后反应的离子方程式书写正确
选项
离子组
加入试剂
发生反应的离子方程式
A
Fe3+、I-、Cl-
NaOH溶液
Fe3+ + 3OH- =Fe(OH)3↓
B
K+、ClO-、SO42-
盐酸
H++ClO- =HClO
C
K+、OH-、Cl-
过量SO2
SO2+ OH-=HSO3-
D
H+、Fe2+、 SO42-
Ba(NO3)2溶液
SO42-+ Ba2+ =BaSO4↓
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y、Z、M、P是原子序数依次增大的短周期元素。其中X与M、Y与P同主族,M的氧化物是制造光纤的基本原料,P的一种氧化物可用于自来水消毒,Z的单质既能与强酸又能与强碱反应。下列说法中不正确的是 ( )
A. 单质的氧化性由强到弱的顺序是:Y> P
B. 工业上用电解熔融Z的氧化物的方法冶炼Z
C. M的氧化物可与Y的氢化物的水溶液反应
D. 氧化物的水化物酸性由强到弱的顺序是:P> X
难度: 中等查看答案及解析
-
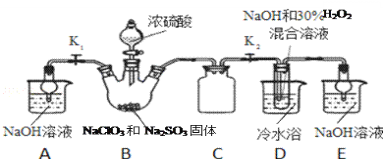
关于下列各装置图的叙述中,不正确的是
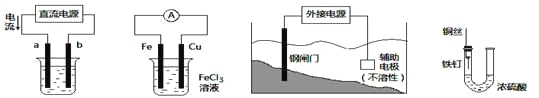
① ② ③ ④
A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C. 装置③中钢闸门应与外接电源的负极相连
D. 装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
下列有关说法中正确的是
A. 某温度时的混合溶液中c(H+)=
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B. 由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C. 已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
难度: 中等查看答案及解析
-
已知常温下浓度为0.1 mol·L-1的下列溶液的pH如下表所示:
溶质
NaF
NaClO
NaHCO3
Na2CO3
pH
7.5
9.7
8.2
11.6
下列有关说法不正确的是( )
A. 电离平衡常数大小关系:K(HF)> K(H2CO3 )>K(HClO)>K( HCO3-)
B. 加热0.1 mol·L-1 NaClO溶液测其pH,pH大于9.7
C. 0.1 mol·L-1 Na2CO3溶液中,存在关系:c(OH-)=c(H+) +c(HCO3-)+2c(H2CO3)
D. pH=2的HF溶液与pH=12的NaOH溶液以体积比1∶1混合,则有:c(Na+)> c(F-)> c(H+)> c(OH-)
难度: 困难查看答案及解析