-
户外运动常带便餐自热饭,其“发热包”遇水即可发热,原理主要是将化学能转化为热能,“发热包”中可能含有下列物质中的( )
A. 氯化钠 B. 固体硝酸铵 C. 生石灰 D. 蔗糖
难度: 简单查看答案及解析
-
将25 ℃的纯水加热至80℃,下列叙述正确的是( )
A. 水的离子积不变,呈中性
B. 水中c(H+) = c(OH-) > 1×10-7 mol/L
C. 水的pH变大,呈中性
D. 水的pH变小,呈酸性
难度: 简单查看答案及解析
-
用锌片与稀硫酸反应制取氢气,下列措施不能使氢气的生成速率增大的是( )
A. 加热 B. 将锌片改成锌粉
C. 滴加少量CuSO4溶液 D. 加入适量Na2CO3粉末
难度: 简单查看答案及解析
-
下列热化学方程式表达正确的是( )
A. C2H5OH(g) + 3O2(g) = 2CO2(g) + 3H2O(l) △H = -1499.0 kJ/mol(燃烧热)
B. NaOH(aq) + HC1(aq) = NaCl(aq) + H2O(1) △H = +57.3 kJ/mo1(中和热)
C. S(s) + O2(g) = SO2(g) △H = +269.8 kJ/mo1(反应热)
D. 2NO2 = O2 + 2NO △H = +116.2 kJ/mo1(反应热)
难度: 简单查看答案及解析
-
某无色溶液能与A1反应产生H2,该溶液中可能大量共存的离子组是( )
A. K+、Na+、MnO4-、NO3-
B. NH4+、Mg2+、SO42-、NO3-
C. Al3+、Ba2+、HCO3-、NO3-
D. K+、Ba2+、Cl-、NO3-
难度: 中等查看答案及解析
-
为了配制NH4+与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
①适量的HC1 ②适量的NH4NO3 ③适量的氨水 ④适量的NaOH
A. ①② B. ②③ C. ③④ D. ①②③④
难度: 中等查看答案及解析
-
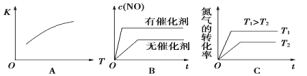
已知吸热反应2CO(g) = 2C(s) + O2(g),假设△H和△S不随温度而变,下列说法中正确的是( )
A. 低温下能自发进行 B. 高温下能自发进行
C. 任何温度下都不能自发进行 D. 任何温度下都能自发进行
难度: 简单查看答案及解析
-
将NO2装入带活塞的密闭容器中,当反应2NO2(g)
N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是( )
A. 升高温度,气体颜色加深,则此正反应为吸热反应
B. 慢慢压缩气体体积,平衡向右移动,混合气体颜色较原来深
C. 慢慢压缩气体使体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入惰性气体,压强增大,平衡不会移动
难度: 困难查看答案及解析
-
在10 mL 0.1 mol/L NaOH溶液中加入10 mL 0.2 mol/L的CH3COOH溶液,反应后溶液中各粒子的浓度关系正确的是( )
A. c(Na+)>c(CH3COO-)>c(OH-)>c(H+) B. c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C. c(CH3COO-) + c(CH3COOH) = 0.2 mol/L D. c(Na+) + c(H+) = c(CH3COO-) + c(OH-)
难度: 中等查看答案及解析
-
下列实验过程不能达到实验目的的是( )
编号
实验目的
实验过程
A
探究化学能可转化为热能
在试管中加入3 mL 6 mo1/L的盐酸,再插入用砂纸打磨过的铝条,并用温度计测量温度的变化
B
比较弱电解质的相对强弱
向两支分别盛有0.1 mo1/L醋酸和饱和硼酸溶液的试管中滴加等浓度的碳酸钠溶液,观察现象
C
探究浓度对反应速率的影响
向2支盛有5 mL不同浓度 NaHSO3溶液的试管中同时加入2 mL 5% H2O2溶液,观察现象
D
探究催化剂对反应速率的影响
向2支盛有2 mL 5% H2O2溶液的试管中分别同时滴加1 mL 0.l mol/L FeCl3和CuCl2溶液,摇匀观察现象
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则( )
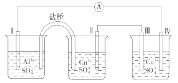
A. 电极Ⅰ发生还原反应 B. 电极Ⅱ逐渐溶解
C. 电极Ⅲ的电极反应:Cu - 2e- = Cu2+ D. 电子移动方向:电极Ⅳ→A→电极Ⅰ
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g) + 3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不正确的是( )
A. c1:c2 = 1:3 B. 平衡时,Y和Z的生成速率之比为3:2
C. X、Y的转化率相等 D. c3的取值范围为0 mol/L < c3 < 0.14 mol/L
难度: 中等查看答案及解析
-
pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )

A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若a小于5,则A、B都是弱酸,且A的酸性弱于B
难度: 困难查看答案及解析
-
在一定条件下,可逆反应A(g) + B(g)
mC(g)变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,下列说法正确的是( )
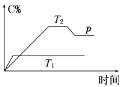
A. T1 < T2
B. 正反应是放热反应
C. m<2
D. 恒温、恒容充入稀有气体,平衡逆向移动
难度: 中等查看答案及解析
-
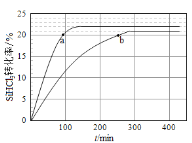
在一定温度下,将气体0.22 mol X和气体0.16 mol Y充入5 L恒容密闭容器中,发生反应2X(g) + Y(g)
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是( )
A. 该温度下此反应的平衡常数K = 72.0 L/mol
B. 反应前2 min的平均速率υ(Z) = 4.0×10-3 mol/(L·min)
C. 其他条件不变,降低温度,反应达到新平衡前υ(逆) > υ(正)
D. 其他条件不变,再充入0.1 mo1 X,新平衡时X的转化率将增大
难度: 困难查看答案及解析
-
室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mo1/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )
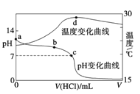
A. a点由水电离出的c(H+) = 1.0 × 10-14 mo1/L
B. b点:c(NH4+) > c(Cl-) > c(OH-) > c(H+)
C. c点:盐酸与氨水恰好完全反应
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
难度: 困难查看答案及解析