-
苯乙烯是重要的化工原料。下列有关苯乙烯的说法错误的是
A. 与液溴混合后加入铁粉可发生取代反应
B. 能使酸性高锰酸钾溶液褪色
C. 与氯化氢反应可以生成氯代苯乙烯
D. 在催化剂存在下可以制得聚苯乙烯
难度: 中等查看答案及解析
-
向0.5L下列溶液中加入10gNaOH固体,溶液的导电能力基本没有变化的是
A. 0.5 mol•L﹣1醋酸 B. 0.5 mol•L﹣1 NaOH溶液
C. 0.5 mol•L﹣1硝酸 D. 0.5 mol•L﹣1K2SO4
难度: 简单查看答案及解析
-
某酸溶液的pH=1,此酸溶液的物质的量浓度
A. 0.1 mol·L-1
B. 一定大于0.1 mol·L-1
C. 若为强酸一定等于0.1 mol·L-1,若为弱酸一定大于0.1 mol·L-1
D. 若为强酸一定≤0.1 mol·L-1,若为弱酸一定>0.1 mol·L-1
难度: 简单查看答案及解析
-
能促进水的电离,并使溶液中c(H+)>c(OH)的操作是
(1) 将水加热煮沸 (2) 向水中投入一小块金属钠 (3) 向水中通HCl (4) 向水中加入明矾晶体 (5)向水中加入NaHCO3固体 (6)向水中加KHSO4固体
A. (4) B. (1)(4)(6) C. (1)(3)(6) D. (4)(6)
难度: 中等查看答案及解析
-
下列溶液一定呈酸性的是
A. pH=6的溶液 B. 能与金属Al反应放出H2的溶液
C. 遇酚酞显无色的溶液 D. c(H+)>c(OH-)的溶液
难度: 中等查看答案及解析
-
物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其PH依次为10、9、8,则HX、HY、HZ的酸性由强到弱的顺序是
A. HX>HZ>HY B. HZ>HY>HX C. HX>HY>HZ D. HY>HX>HZ
难度: 中等查看答案及解析
-
在下列叙述中,不能说明醋酸是弱电解质的是
A. 醋酸中加水后,溶液的pH升高
B. 室温下,0.1mol·L-1的CH3COOH溶液的pH=3
C. 室温下,0.1mol·L-1的CH3COONa溶液的pH=8
D. 0.1mol·L-1的CH3COOH导电能力不如0.1mol·L-1的盐酸强
难度: 简单查看答案及解析
-
下列各组离子在特定条件下一定能够大量共存的是
A. 遇Al能放出H2的溶液:SO42—、K+、Na+、Cl-
B. 水电离出的OH-的浓度为1×10-10 mol/L的溶液:SO42—、Cl-、K+、Ba2+
C. 能使石蕊试纸变红色的溶液:K+、Fe2+、NO3—、Na+
D. 含有较多Fe3+的溶液:Na+、SO42—、I-、NH4+
难度: 困难查看答案及解析
-
下列叙述正确的是
A. 两种难溶性盐,Ksp较小的,其溶解度也一定较小
B. 相同条件下,HA比HB易电离,则NaA溶液的pH比NaB溶液的pH小
C. 稀释醋酸钠溶液,CH3COO- 水解程度变大,故溶液的pH增大
D. 稀释氨水溶液,溶液中所有离子的浓度都降低
难度: 中等查看答案及解析
-
已知常温下的醋酸铵溶液呈中性,下列叙述正确的是
A. 醋酸铵溶液中水的电离程度与纯水相同
B. 由醋酸铵溶液呈中性可推知NH4HCO3溶液pH<7
C. 1mol/L醋酸铵溶液中c(CH3COO-)<1mol/L
D. 在99mL的醋酸铵溶液中加入1mL pH=2的盐酸,所得溶液pH=4
难度: 中等查看答案及解析
-
由表格中的电离平衡常数判断可以发生的反应是
化学式
电离常数
HClO
K=3×10-8
H2CO3
K1=4.4×10-7
K2=4.7×10-11
A. NaClO + NaHCO3 = HClO + Na2CO3 B. NaClO+ CO2+ H2O = HClO + NaHCO3
C. 2NaClO+ CO2+ H2O = 2HClO + Na2CO3 D. 2HClO + Na2CO3 = 2NaClO + CO2↑+ H2O
难度: 困难查看答案及解析
-
下列有关实验中,会导致所配制(或所测定)溶液浓度偏高的是(其它操作均正确)
A. 用标准NaOH滴定未知浓度的CH3COOH,用甲基橙作指示剂,溶液由红色变橙色立即停止滴定
B. 用容量瓶配制100 mL 5 mol/L氯化钠溶液试验中,定容时仰视
C. 用标准盐酸滴定待测NaOH溶液试验中,使用碱式滴定管开始平视,后来俯视读数
D. 用标准NaOH溶液滴定待测盐酸实验中,碱式滴定管开始无气泡,后来有气泡
难度: 中等查看答案及解析
-
糖类、蛋白质、油脂是人体重要的营养物质,下列有关说法不正确的是( )
A. 麦芽糖在人体内的水解产物能和银氨溶液发生反应
B. 淀粉、纤维素、蛋白质和油脂都是有机高分子化合物
C. 在鸡蛋清溶液中加入饱和的Na2SO4溶液时,会使蛋白质析出
D. 在一定条件下氨基酸之间能发生反应,合成更复杂的化合物(多肽),构成蛋白质
难度: 简单查看答案及解析
-
十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是
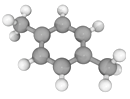
A. “PX”的二氯代物共有6种(不考虑立体异构) B. “PX”的分子式为C8H10
C. “PX”分子中,最多有14个原子共面 D. 可用酸性KMnO4溶液鉴别“PX”与苯
难度: 中等查看答案及解析
-
下列电离方程式或离子方程式正确的是
A. NaHCO3电离:NaHCO3=Na++H++CO32-
B. NH4+水【解析】
NH4++H2ONH3·H2O+H+
C. H3PO4电离:H3PO4====3H++PO43-
D. CO32-水解:CO32-+H2O
H2CO3+2OH-
难度: 简单查看答案及解析
-
下列示意图中,正确的是
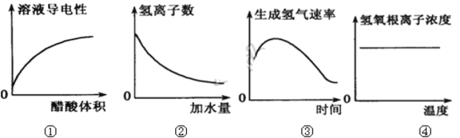
A. 图①表示烧碱溶液中滴加稀醋酸 B. 图②表示稀醋酸加水稀释
C. 图③表示镁与一定量的盐酸反应 D. 图④表示加热纯碱溶液
难度: 中等查看答案及解析
-
化合物
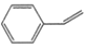 (甲)、
(甲)、(乙)、
 (丙)的分子式均为C8H8,下列说法不正确的是
(丙)的分子式均为C8H8,下列说法不正确的是A. 甲、乙、丙在空气口燃烧时均产生明亮并带有浓烟的火焰
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物数目最少的是丙
难度: 简单查看答案及解析
-
甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法不正确的是
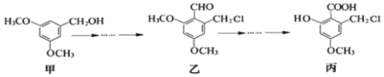
A. 甲分子苯环上的一氯代物有两种
B. 乙、丙均可与NaOH溶液发生反应
C. 乙分子中所有碳原子可能位于同一个平面
D. 甲、乙、丙三种有机化合物都能发生银镜反应
难度: 中等查看答案及解析
-
分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如右图。下列说法中不正确的是
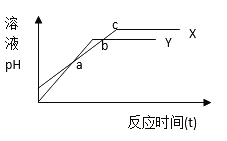
A. Y代表盐酸与镁条的反应 B. a点时反应Y消耗镁条的量少
C. b点表示此时两溶液pH相等 D. c点表示此时反应结束
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是
A. pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3)
B. 已知0.1 mol·L-1 二元酸H2A溶液的pH=4,则在0.1 mol·L-1 Na2A溶液中:c(OH-) = c(HA-) + c(H+) + 2c(H2A)
C. 将0.1 mol·L-1醋酸溶液加水稀释,则溶液中的c(H+)和c(OH-)都减小
D. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3.H2O)增大
难度: 困难查看答案及解析
-
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述中正确的有
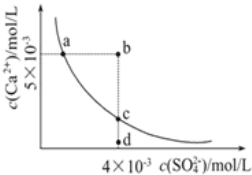
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
A. 2个 B. 3个 C. 4个 D. 5个
难度: 困难查看答案及解析
-
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。 下列说法正确的是
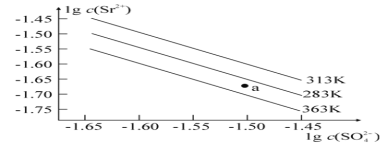
A. 三个不同温度中,363K时Ksp(SrSO4)最大
B. 温度一定时,Ksp(SrSO4) 随c(SO42-) 的增大而减小
C. 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
D. 283K时,图中a点对应的溶液是不饱和溶液
难度: 困难查看答案及解析
-
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
A. CuS的溶解度大于PbS的溶解度
B. 原生铜的硫化物具有还原性,而铜蓝没有还原性
C. CuSO4与ZnS反应的离子方程式是
CuS↓
D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
难度: 中等查看答案及解析
-
化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 −甲基丙烯酰氯在一定条件下反应制得:
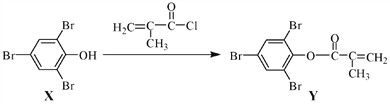
下列有关化合物X、Y 的说法正确的是
A. X 分子中所有原子一定在同一平面上 B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色 D. X→Y的反应为加成反应
难度: 中等查看答案及解析
-
工业上可用甲苯合成苯甲醛:
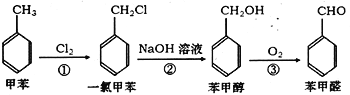 ,
,下列说法正确的是
A. 甲苯分子中所有原子都在同一平面内 B. 反应①②③的反应类型相同
C. 一氯甲苯的同分异构体有3种 D. 苯甲醇可与金属钠反应
难度: 中等查看答案及解析
-
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有
A. 15种 B. 28种 C. 32种 D. 40种
难度: 中等查看答案及解析
-
四种常见有机物的比例模型如下图。下列说法正确的是

A. 乙可与溴水发生取代反应而使溴水褪色
B. 甲能使酸性KMnO4溶液褪色
C. 丙中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键
D. 丁为醋酸分子的比例模型
难度: 简单查看答案及解析
-
下列有机物说法不正确的是
A. BrCH2CHBrCH2Br的名称为三溴丙烷
B. 萘环上的一个H原子被-C4H9取代后的产物共有8种
C. 对甲基苯乙烯中最多有17个原子共面
D. 纤维素和淀粉都是多糖,它们彻底水解后的产物相同
难度: 中等查看答案及解析
-
阿斯巴甜(Aspartame)是一种具有清爽甜味的有机化合物,结构简式如图所示。下列说法不正确的是
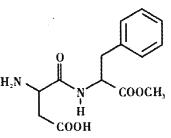
A. 阿斯巴甜属于氨基酸,分子式为C14H18N2O5
B. 阿斯巴甜能发生氧化、取代、消去等反应
C. 阿斯巴甜分子的核磁共振氢谱共有11种吸收峰
D. 阿斯巴甜在一定条件下既能与酸反应,又能与碱反应
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇
B. HOCH2CH(CH3)2与(CH3)3COH属于碳链异构
C. 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
D. 一个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种
难度: 中等查看答案及解析
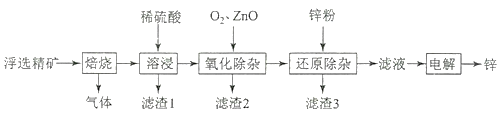
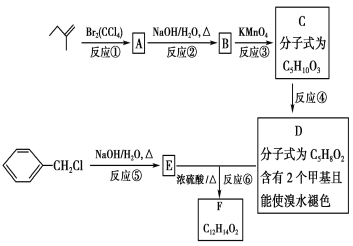
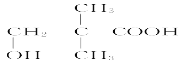 和______________________________。
和______________________________。