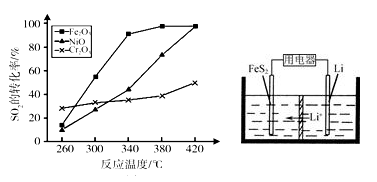
-
化学与社会、生产、生活紧切相关。下列说法正确的是
A. 石英只能用于生产光导纤维
B. 从海水提取物质都必须通过化学反应才能实现
C. 为了增加食物的营养成分,可以大量使用食品添加剂
D. 减少使用一次性筷子、纸杯、塑料袋等有利于环境保护
难度: 中等查看答案及解析
-
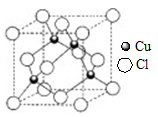
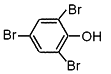
下列有关卤族元素及其化合物的表示正确的是
A. 氮气分子的电子式:
B. 中子数为34,质子数为29的铜原子:6334Cu
C. 2,4,6-三溴苯酚的结构简式:
D. 氯离子的结构示意图:

难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 浓硫酸具有脱水性,可用于干燥氯气 B. FeCl3溶液有酸性,常用于蚀刻电路板
C. 炭具有强还原性,常用于冶炼钠、钾等金属 D. 碳酸氢钠溶液具有弱碱性,可用于制胃酸中和剂
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子的最外层电子数之和为12,Y、Z、W位于同一周期,Z原子的最外层电子数既是X原子内层电子总数的3倍,又是Y原子最外层电子数的3倍。下列说法不正确的是( )
A. 原子半径:Y>X,离子半径Z<W
B. 元素Y的单质能与元素X的最高价氧化物发生置换反应
C. 元素Y和W能形成YW2型离子化合物
D. W的单质有毒,能使湿润的有色布条褪色
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 用强碱溶液吸收工业制取硝酸尾气:NO + NO2+2OH-=2NO3-+H2O
B. 向硝酸银溶液中滴加氨水至过量:Ag+ + NH3·H2O=AgOH↓+ NH4+
C. 用MnO2与浓盐酸反应制Cl2: MnO2+4H++4Cl-
Mn2+ +Cl2↑+ 2H2O
D. 在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3C1O-+2 Fe(OH)3+4OH-=2 FeO42-+3Cl-+5H2O
难度: 中等查看答案及解析
-
NaOH标准溶液的配制和标定,需经过NaOH溶液配制,基准物质H2C2O4·2H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是
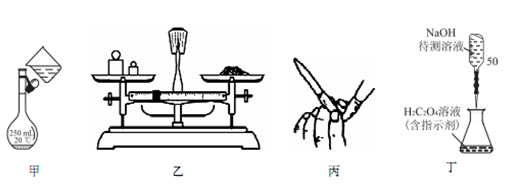
A. 用图甲所示操作转移NaOH 溶液到容量瓶中
B. 用图乙所示装置准确称得0.1575gH2C2O4·2H2O固体
C. 用图丙所示操作检查碱式滴定管是否漏液
D. 用图丁所示装置以NaOH 待测液滴定H2C2O4溶液
难度: 中等查看答案及解析
-
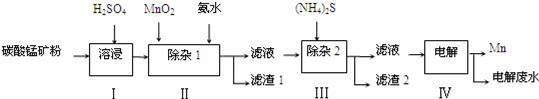
一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关反应的说法正确的是
A. 反应中MnO2是还原剂
B. 电池工作时,海水起导电作用,其中NaCl浓度保持不变
C. Ag为负极,电极反应为Ag-e-+Cl-=AgCl
D. 每生成1 mol Na2Mn5Ol0转移1mol电子
难度: 中等查看答案及解析
-
向Fe和Al2O3的混合物中加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A. 通入过量Cl2: Cl-、SO42-、Fe2+、Al3+
B. 加入过量NaOH溶液:SO42-、Na+、AlO2-、OH-
C. 加入过量氨水:NH4+、SO42-、Na+、AlO2-
D. 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+
难度: 困难查看答案及解析
-
在给定条件下,下列选项所示的物质均能实现的是
A. SiO2
SiCl4
Si
B. Al2O3
NaAlO2(aq)
Al(OH)3
C. S
SO3
H2SO4
D. Fe2O3
FeCl3(aq)
无水 FeCl3
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符的是
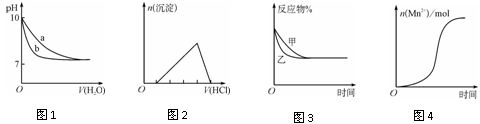
A. 图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
B. 图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
C. 图3表示压强对可逆反应CO(g)+H2O(g)
CO2(g)+H2(g)的影响,乙的压强比甲的压强大
D. 图4表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
难度: 困难查看答案及解析
-
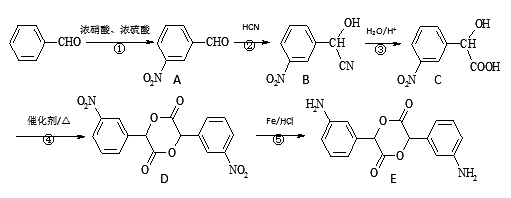
增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得:
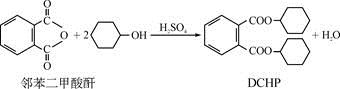
下列叙述正确的是
A. 邻苯二甲酸酐的二氯代物有3种
B. 环己醇分子中所有的原子可能共平面
C. DCHP能发生加成、取代、消去反应
D. 1 mol DCHP最多可与含2 mol NaOH的烧碱溶液反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH<0ΔS>0
B. 水解反应NH4++H2O
NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
C. 铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D. 对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作与现象
结论
A
将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液,
溶液变成红色
Fe(NO3)2中一定含Fe3+
B
从煤油中取出一小块钠,用滤纸擦净表面的煤油,
放入无水乙醇中,产生气泡
Na能置换出醇烃基中的氢
C
将某气体通入品红溶液,溶液褪色
气体一定是SO2
D
向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀
AlO2-结合H+的能力比CO32-强
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,向1L0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法正确的是
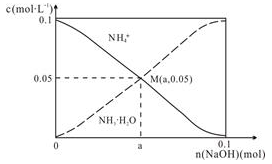
A. M点溶液中水的电离程度比原溶液大
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D. 随着NaOH的加入,一定存在c(Cl-)+ c(OH-)+c(NH3·H2O)>0.1 mol·L-1
难度: 困难查看答案及解析
-
臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)
N2O5(g)十O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
3
6
12
24
n(O2)/mol
0
0.36
0.60
0.80
0.80
下列有关说法正确的是
A. 反应在0~3s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1,则反应的ΔH<0
C. 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
D. 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%
难度: 困难查看答案及解析