-
(12分)锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
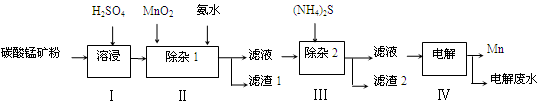
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是 。
(5)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥ mol·L-1。
-
锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
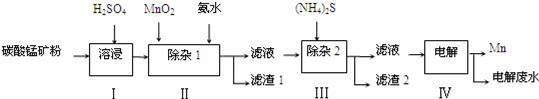
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10﹣13 | 3.0×10﹣16 | 5.0×10﹣16 | 1.0×10﹣11 | 5.0×10﹣22 | 1.0×10﹣22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 ;
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ ;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ;
加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有 ;滤渣2的主要成分是 ;
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10﹣5mol•L﹣1,则应保持溶液中c(S2﹣)≥ mol•L﹣1.
-
铜是人类最早使用的金属之一。也是中学中常见的过镀金属元素。铜是与人类关系非常密切的有色金属。被广泛地作力导线应用于电气、轻工、机械制造、建筑工业、国防工业等领域在中国有色金属材料的消费中仅次于铝。回答下列问题:
(1)基态Cu+原子核外电子排式为___。
(2)CuCl晶体的晶格能可通过如图的Born-Haber循环计算得到:
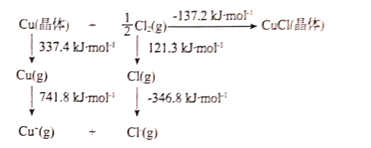
铜原子的第一电离能为___kJ•mol-1;Cl-Cl键键能为___kJ•mol-1;CuCl的晶格能为___kJ•mol-1。
(3)铜盐属于重金属盐,铜盐中毒可用青霉胺解毒,解毒原理如下:Cu2+能与青霉胺成环状络合物,该环状络合物无毒、易溶于水,可经尿液排出。
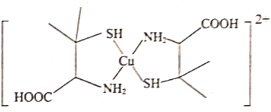
①青霉胺分子中S原子的轨道杂化类型为___;
②硫化氢与氨气键角的大小:H2S___NH3(填“>”或“<”)。
③第二周期元素中,第一电离能大于N的元素有___(用元素符号表示)。
④该环状络合物无毒、易溶于水,可经尿液排出,请解释该化合物易溶于水的主要原因:___。
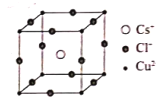
(4)某含铜的离子化合物M由Cs、Cu、Cl三种元素构成,M属于立方体晶系的离子晶体,其结构如图所示。试回答下列问题:
①离子化合物M的化学式为___;
②已知Cs和Cl两元素离子的半径大小相近,该晶体中两种离子联合组成何种形式的密堆积___;
③若晶胞参数为anm,则这种晶体密度为___g•cm-3(用含a、和NA的式子表示)。
-
下列对金、银、铜的描述错误的是( )
A.金在电子工业中的用量占金在工业用量的90%以上
B.金在自然界中主要以游离态存在,可用物理方法提取
C.银在有机合成.能源开发.材料制造等方面有广泛的应用前景
D.因为铜的导电.导热性不如金和银,故制造电线.电缆的材料绝大部分换成了金或银
-
镍及其化合物在工业生产中有着广泛的运用,当前世界上镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。回答下列问题:
(1)镍元素在元素周期表中位于__________,在基态镍原子中,其核外电子有_______种不同运动状态,M层电子排布式为______________________。
(2)在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。在该结构中,氮镍之间形成的化学键是__________,碳原子的杂化轨道类有_______________,非金属元素的电负性由大到小的顺序是_________________。

(3)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18) =Cr的价电子数(6)+CO提供电子数(2×6)。Ni原子与CO形成配合物的化学式为______________。该配合物常温下为液态,易溶于CCl4、苯等有机溶剂,据此判断该分子属于____________分子(填“极性”或“非极性”)。
(4)甲醛在Ni催化作用下加氢可得甲醇。甲醇分子内的O-C-H键角_____________(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角;甲醇易溶于水的原因是______________。
(5)NixO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm.晶胞中两个Ni原子之间的最短距离为_______pm。若晶体中的Ni离子分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为____________。
-
五氧化二钒及其他钒的化合物广泛应用于钢铁、有色合金、化工、炼油、玻璃及陶瓷等工业部门。可从含钒石煤灰渣中提钒,该试验工艺流程如下图:

表1 灰渣主要化学成分分析/%
| V2O3 | SiO2 | Fe2O3 | Al2O3 | MgO | K2O | CaO | 烧失量 |
| 1.26 | 55.71 | 6.34 | 7.54 | 1.26 | 3.19 | 1.41 | 20.55 |
表2中间盐主要成分分析/%(以氧化物形式表示其含量)
| V2O3 | Al2O3 | Fe2O3 | MgO | K2O |
| 5.92 | 1.70 | 18.63 | 2.11 | 3.38 |
已知:
①石煤灰渣的化学成分分析见表1,中间盐的主要成分分析见表2。
②矿物焙烧过程中,若温度过高,易发生烧结,温度越高,烧结现象越严重。
③萃取反应可以表示为:VO2++(HR2)PO4(o)→VO[R2PO4]R(o)+H+,(o)表示有机相
④有机萃取剂(HR2)PO4萃取VO2+的能力比萃取V02+要强。
请回答:
(1)提高浸取率的方法有____________,残渣的主要成分为_______________________,
(2)经几级萃取后,有时候要适当加酸调整pH值,结合萃取反应方程式,说明原因_____________。反萃取操作应加入_____________试剂。
(3)中间盐溶解过程中,加铁粉的主要目的是_____________________。
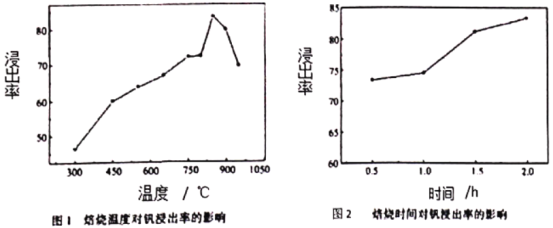
(4)石煤中的钒以V(Ⅲ)为主,有部分V(Ⅳ),很少见V(Ⅴ)。如图1和如图2分别为焙烧温度和焙烧时间对钒浸出率的影响,由如图2可得最佳焙烧时间为______________h,由如图1可得最佳焙烧温度为800-850℃之间,焙烧温度在850℃以下时,钒浸出率随焙烧温度的上升几乎直线上升的原因是_________________________,当焙烧温度高超过850℃以后,再提高温度,浸出率反而下降的可能原因是:_________________________。
(5)反萃取液中的VO2+,加入氯酸钠后被氧化为VO2+,请写出该反应的离子方程式______________。然后用氨水调节pH到1.9~2.2沉钒,得多钒酸铵沉淀(化学式为(NH4)2V12O31·nH2O),再经固液分离、干燥、焙烧得五氧化二钒产品,请写出此步反应的化学方程式____________________________。
-
(15分)目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题:
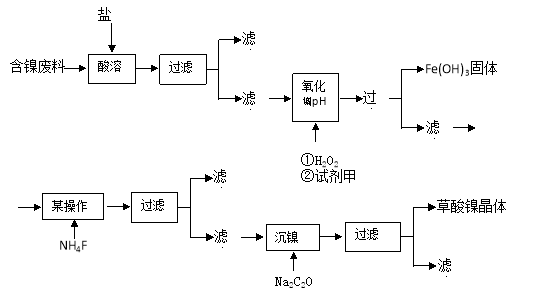
(1)加6%的H2O2时,温度不能太高,其目的是 。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况 。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH= 。
(3)流程中加入NH4F的目的是 。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式 。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式 ;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6  LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
-
(20分)亚硝酸钠是一种工业盐,用途广泛,外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
(一)鉴别NaCl和NaNO2
(1)测算溶液pH
常温下,用pH试纸分别测定0.1 mol·L-1两种盐溶液的pH,测得NaNO2溶液呈碱性。
NaNO2溶液呈碱性的原因是________________(用离子方程式解释)。
NaNO2溶液中HNO2的准确浓度为________mol·L-1(测得NaNO2溶液pH=b,用含b的代数式表示)。
(2)沉淀法
取2 mL 0.1mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两只试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=1.8×10-8(mol2/L2);Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s)+Cl-(aq) AgCl(s)+NO2-(aq)的化学平衡常数K=________。
AgCl(s)+NO2-(aq)的化学平衡常数K=________。
(3)氧化法
取2 mL 0.1mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液,使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为______________________________。
(二)NaNO2性质探究
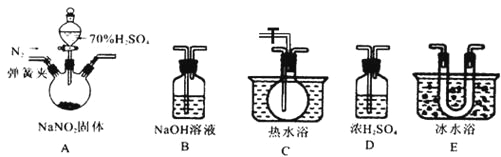
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
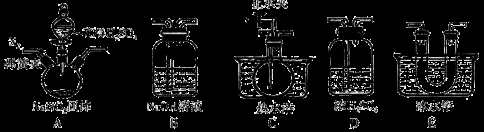
已知:气体的液化温度:NO221℃、NO–152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→_______→_________→_________→_________;组装好仪器后,接下来须进行的操作是_________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸溶液后,A中产生红棕色气体。
①如何验证A中产生的气体中含有NO_________。(写出实验操作、现象和结论)
②装置E的作用是_____________________________。
③A装置中发生反应的化学方程式为_________________________________________。
-
亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液PH
用PH试纸分别测定0.1mol·L-1两种盐溶液的PH,测得NaNO2溶液呈碱性。NaNO2溶液呈碱性的原因是 ________________________(用离子方程式解释)。NaNO2溶液中c(HNO2)=_____________(用溶液中其它离子的浓度关系式表示)
(2)沉淀法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液。两只试管均产生白色沉淀。分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=2×10-8(mol·L-1)2; Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s) +Cl-(aq) AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
(3)氧化法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液。使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为____________。
㈡NaNO2性质探究
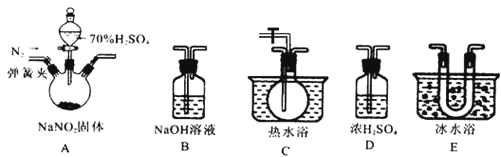
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
已知: 气体液化的温度:NO221℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→______→ ______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①如何确认A中产生气体是否含有NO _________。(写出实验操作、现象和结论)
②装置E的作用是_______________________。
③若向D中通入过量O2,则装置B中发生反应的化学方程式为____________。
-
亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液PH
用PH试纸分别测定0.1mol·L-1两种盐溶液的PH,测得NaNO2溶液呈碱性。NaNO2溶液呈碱性的原因是 ________________________(用离子方程式解释)。NaNO2溶液中c(HNO2)=_____________(用溶液中其它离子的浓度关系式表示)
(2)沉淀法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液。两只试管均产生白色沉淀。分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=2×10-8(mol·L-1)2; Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s) +Cl-(aq) AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
(3)氧化法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液。使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为____________。
㈡NaNO2性质探究
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
已知: 气体液化的温度:NO221℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→______→ ______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①如何确认A中产生气体是否含有NO _________。(写出实验操作、现象和结论)
②装置E的作用是_______________________。
③若向D中通入过量O2,则装置B中发生反应的化学方程式为____________。











