-
镍及其化合物在工业生产中有着广泛的运用,当前世界上镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。回答下列问题:
(1)镍元素在元素周期表中位于__________,在基态镍原子中,其核外电子有_______种不同运动状态,M层电子排布式为______________________。
(2)在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。在该结构中,氮镍之间形成的化学键是__________,碳原子的杂化轨道类有_______________,非金属元素的电负性由大到小的顺序是_________________。

(3)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18) =Cr的价电子数(6)+CO提供电子数(2×6)。Ni原子与CO形成配合物的化学式为______________。该配合物常温下为液态,易溶于CCl4、苯等有机溶剂,据此判断该分子属于____________分子(填“极性”或“非极性”)。
(4)甲醛在Ni催化作用下加氢可得甲醇。甲醇分子内的O-C-H键角_____________(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角;甲醇易溶于水的原因是______________。
(5)NixO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm.晶胞中两个Ni原子之间的最短距离为_______pm。若晶体中的Ni离子分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为____________。
-
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力.
(1)基态Ni原子的核外电子排布式为______.
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式为______.
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③ 、④HCHO等,其中碳原子采取sp2杂化的分子有______(填物质序号),预测HCHO分子的立体结构为______形.
、④HCHO等,其中碳原子采取sp2杂化的分子有______(填物质序号),预测HCHO分子的立体结构为______形.
(4)NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为______;Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______ FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示.该合金的化学式为______;
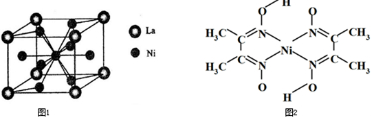
(6)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键______.
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
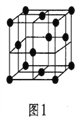
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
-
金属和非金属及其化合物在日常生产生活中有着广泛的运用,请回答下列问题:
(1)硅单质、硅的氧化物、硅酸盐产品在日常生活中广泛的运用:
①硅在周期表中的位置:
②硅酸钠是为数不多的溶于水的硅酸盐,硅酸钠显 性,向硅酸钠溶液中通入足量CO2有白色沉淀产生,写出该反应的离子反应方程式:
(2)铜不能与稀硫酸共热发生反应,但在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式: 。硫酸在该反应中表现的性质是
(3)纳米金属铁能高效地降解毒性强、难生物降解的有机卤化物,科技工作者利用Fe2O3和CH4在一定条件下制得纳米级单质铁,同时两种可燃性气体,则该反应的化学反应方程式为:
(4)Fe3O4是磁铁矿的主要成分,Fe3O4可用于制造录音磁带和电讯器材等。高温下,铝粉能与Fe3O4发生铝热反应,该反应的化学方程式为 。34.8g Fe3O4与足量稀硝酸反应,被还原HNO3的物质的量为 mol。
-
(15分)目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题:
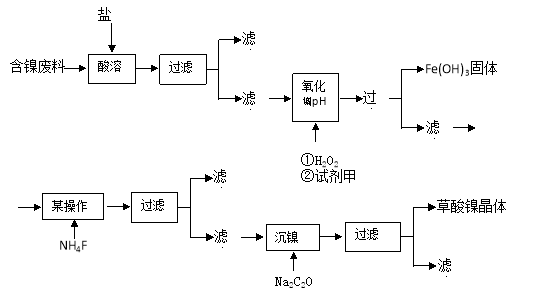
(1)加6%的H2O2时,温度不能太高,其目的是 。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况 。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH= 。
(3)流程中加入NH4F的目的是 。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式 。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式 ;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6  LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
-
铁是地壳中含量仅次于铝的金属元素.铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是 ,若有
,若有 参加反应,转移电子的物质的量是 ______ mol.
参加反应,转移电子的物质的量是 ______ mol.
(2)高铁酸钾 是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和
是一种既能杀菌、消毒,又能絮凝净水的水处理剂.工业制备高铁酸钾的方法为在KOH浓溶液中加入NaClO和 ,并不断搅拌,其发生的反应的离子方程式
,并不断搅拌,其发生的反应的离子方程式 ______
______
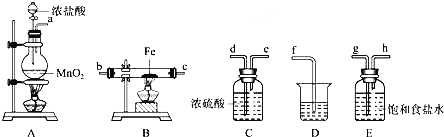
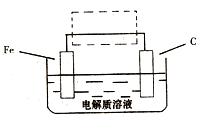
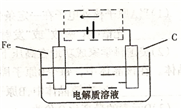
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)已知FeCl3会吸水潮解.
请回答下列问题:
① 中发生反应的化学方程式为 ______ .
中发生反应的化学方程式为 ______ .
②各装置的正确连接顺序为 填写装置代号A
填写装置代号A ______
______  ______
______  ______
______  ______
______ D。
D。 其中C用了两次
其中C用了两次
③装置E的作用是 ______ ,写出装置D中反应的离子方程式 ______ .
④反应开始后,B中硬质玻璃管内的现象为 ______ ;FeCl3常作净水剂,原理是 ______  用离子方程式表示
用离子方程式表示
-
Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe304+4CO 3Fe+4C02,若有1mol
3Fe+4C02,若有1mol
Fe304参加反应,转移电子的物质的量是________mol.
 (2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________
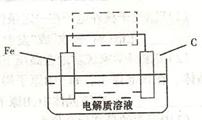
(3)钢铁的电化腐蚀简单示意图如下,将该图稍作修
改即可成为钢铁电化学防护的简单示意图,请在下图虚
线框内作出修改,并用箭头标出电子流动方向。
(4)硫酸亚铁晶体(FeS04·7H20)常作医药上的补血剂。课外研究性小组测定该补血剂中铁元素的含量。实验步骤如下:
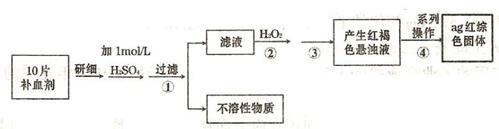
请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,此过程的现象为:
②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH=________(已知溶液中离子浓度小于10-5mol)时,该离子可看做沉淀完全;lg2=0.3)
③步骤④中一系列的操作步骤为:过滤、________、灼烧、冷却、称量。
④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质
量为________g.(用含a的式子表示)
-
Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe34+4CO 3Fe+4C02,若有1mol Fe34参加反应,转移电子的物质的量是______mol;
3Fe+4C02,若有1mol Fe34参加反应,转移电子的物质的量是______mol;
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是______;
(3)钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向______;
(4)硫酸亚铁晶体常作医药上的补血剂.课外研究性小组测定该补血剂中铁元素的含量.实验步骤如下:
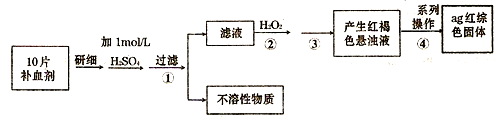
请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加H2O2,此过程的现象为:______;
②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH=______(已知溶液中离子浓度小于10-5mol时,该离子可看做沉淀完全;lg2=0.3);
③步骤④中一系列的操作步骤为:过滤、______、灼烧、冷却、称量;
④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质量为______g.(用含a的式子表示)
-
Fe元素是地壳中最丰富的元素之一,在金属中含量仅次于铝,铁及其化合物在生活生产中有广泛应用。请回答下列问题。
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO 3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是___________________________________________________。
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
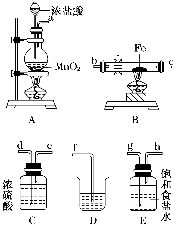
请回答下列问题:
①各装置的正确连接顺序为(填写装置代号)
A→________→________→________→D。
②装置C的作用是_______________________________________________________。
③反应开始后,B中硬质玻璃管内的现象为________;可以检验生成物中含有Fe3+的试剂是________(填写试剂名称)。
-
目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
碱式碳酸镍的制备:
工业用电解镍新液(主要含NiSO4,NiCl2等)制备碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O],制备流程如图:
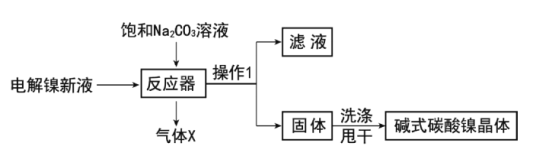
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO3·2Ni(OH)2+3Na2SO4+2X,X的化学式为__。
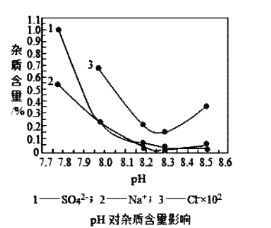
(2)物料在反应器中反应时需要控制反应温度和pH值。分析如图,反应器中最适合的pH值为__。
(3)检验碱式碳酸镍晶体洗涤干净的方法是__。
测定碱式碳酸镍晶体的组成:
为测定碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]组成,某小组设计了如图实验方案及装置:
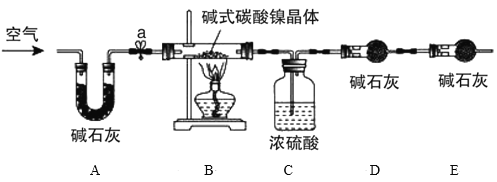
资料卡片:碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
实验步骤:
①检查装置气密性;
②准确称量3.77g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量并记录;
④__;
⑤打开弹簧夹a缓缓鼓入一段时间空气;
⑥分别准确称量装置C、D、E的质量并记录;
⑦根据数据进行计算(相关数据如下表)
| 装置C/g | 装置D/g | 装置E/g |
| 加热前 | 250.00 | 190.00 | 190.00 |
| 加热后 | 251.08 | 190.44 | 190.00 |
实验分析及数据处理:
(4)E装置的作用__。
(5)补充④的实验操作___。
(6)通过计算得到碱式碳酸镍晶体的组成__(填化学式)。
镍的制备:
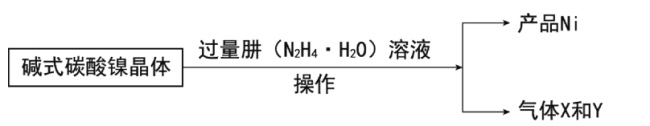
(7)写出制备Ni的化学方程式__。






 (2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________







