-
常温下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明的溶液中:Fe3+、Mg2+、SCN—、Cl—
B. c(H+)/c(OH﹣) =1×10—12的溶液中:K+、Na+、CO32—、NO3—
C. c(Fe2+)=1 mol•L—1的溶液中:K+、NH4+、MnO4﹣、SO42—
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42﹣、HCO3—
难度: 中等查看答案及解析
-
实验操作规范且能达到目的是( )
目的
操作
A.
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
B.
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C.
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D.
配制浓度为0.010mol/L的KMnO4溶液
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列应用不涉及物质氧化性或还原性的是
A. 用葡萄糖制镜或保温瓶胆 B. 用ClO2杀菌、消毒
C. 用Na2SiO3溶液制备木材防火剂 D. 用浸泡过高锰酸钾溶液的硅藻土保鲜水果
难度: 简单查看答案及解析
-
化学与人类生产生活、社会可持续发展密切相关,下列说法不正确的是( )
A. 我们熟悉的塑料、合成橡胶和合成纤维这三大合成材料,都主要是以石油、煤和天然气为原料生产的
B. “春蚕到死丝方尽,蜡炬成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
C. 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
D. 干电池即使不用,放置过久也可能漏液失效,其原因是电解质溶液NH4Cl显酸性和外壳锌反应
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法不正确的是( )
A. 1LpH=3的盐酸与1LpH=3的CH3COOH溶液中,水电离出的H+数目均为10-3NA
B. 0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.1NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数等于0.2mol
难度: 中等查看答案及解析
-
根据SO2通入不同溶液中实验现象,所得结论不正确的是
溶液
现象
结论
A
含HCl、BaCl2的
溶液
产生白色沉淀
SO2有还原性
B
H2S溶液
产生黄色沉淀
SO2有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2有漂白性
D
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A. 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B. 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C. NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D. 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
难度: 简单查看答案及解析
-
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下表所示,其中Q是无机非金属材料的主角。下列判断正确的是( )
A. 离子半径:T<W<G
B. 等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多
C. 最简单气态氢化物的热稳定性:Q<R
D. T和G组成的化合物溶于水,其水溶液呈中性
难度: 中等查看答案及解析
-
恒温、恒压下,将1mol O2和2mol SO2气体充入一体积可变的容器中(状态Ⅰ),发生反应2SO2+O2
2SO3,状态Ⅱ时达平衡,则O2的转化率为( )
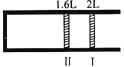
A. 40% B. 60% C. 80% D. 90%
难度: 简单查看答案及解析
-
按如图装置进行实验,下列推断正确的是( )
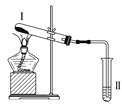
选项
Ⅰ中试剂
Ⅱ中试剂及现象
推断
A
氯化铵
酚酞溶液不变红色
氯化铵稳定
B
硫酸亚铁
品红溶液褪色
FeSO4分解生成FeO和SO2
C
涂有石蜡油的碎瓷片
酸性高锰酸钾溶液褪色
石蜡油发生了化学变化
D
铁粉与水蒸气
肥皂水冒泡
铁粉与水蒸气发生了反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知:X(g)+2Y(g)
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
A. 0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a Kj
D. 升高反应温度,逆反应速率增大,正反应速率减小
难度: 简单查看答案及解析
-
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验。则下列判断正确的是
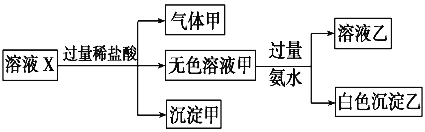
A. 气体甲一定是纯净物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO2-和SiO32-一定存在于溶液X中
D. CO32-和SO42-一定不存在于溶液X中
难度: 中等查看答案及解析
-
常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
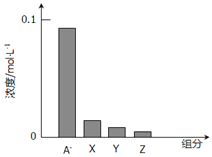
A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
难度: 中等查看答案及解析
-
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是( )
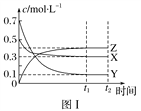
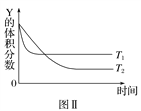
A. 该反应的热化学方程式为X(g)+3Y(g)
2Z(g) ΔH>0
B. 若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率增大
C. 温度分别为T1和T2时的平衡常数大小关系为K2>K1
D. 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
难度: 中等查看答案及解析
-
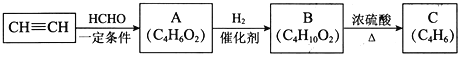
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,下列关于该物质的说法正确的是
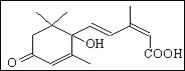
A. 其分子式为C15H16O4
B. 分子中存在4种含氧官能团
C. 既能发生加聚反应,又能发生缩聚反应
D. 1mol该有机物最多可与4molBr2发生加成反应
难度: 中等查看答案及解析
-
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),已知电离平衡常数:CH3COOH>H2CO3>C6H5OH >HCO
,其中不正确的是
A.pH相等的四种溶液:a.CH3COONab.C6H5ONac.NaHCO3d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
D.pH=4浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
难度: 困难查看答案及解析
-
100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g)
N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
难度: 中等查看答案及解析
-
常温下,Ksp(CaSO4)=9×10-6,常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是
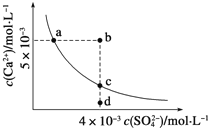
A. a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B. a点对应的Ksp等于c点对应的Ksp
C. b点将有沉淀生成,平衡后溶液中c(SO42-)一定不等于3×10-3mol•L-1
D. 向d点溶液中加入适量CaCl2固体可以变到c点
难度: 中等查看答案及解析
-
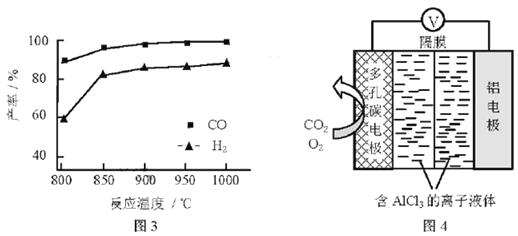
有关下列四个常用电化学装置的叙述中正确的是( )
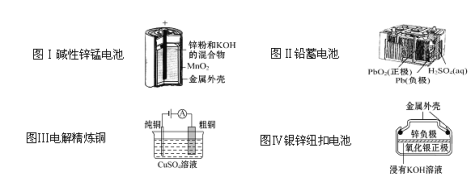
A.图Ⅰ所示电池中,负极电极反应为Zn-2e-
Zn2+
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
难度: 中等查看答案及解析
-
如图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是( )
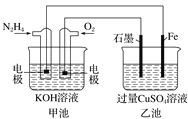
A. 甲池中负极上的电极反应式为N2H4-4e-===N2+4H+
B. 乙池中石墨电极上发生的反应为4OH--4e-===2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1 mol N2H4乙池电极上则会析出6.4 g固体
难度: 中等查看答案及解析
-
下列各示意图与对应的表述正确的是( )

A. 图①表示一定条件下某化学反应的速率随时间变化的趋势图,该反应一定为放热反应
B. 图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液浓度的变化趋势图
C. 图③表示等体积、等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁粉,产生H2的物质的量的变化
D. 图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
难度: 中等查看答案及解析
-
已知,25 ℃时几种弱酸的电离常数如表所示:
弱酸
电离常数
弱酸
电离常数
H2CO3
Ka1=4.3×10-7
Ka2=5.6×10-11
H2C2O4
(草酸)
Ka1=5.9×10-2
Ka2=6.4×10-5
H3PO4
Ka1=7.1×10-3
Ka2=6.3×10-8
Ka3=4.2×10-13
H3C6H5O7
(柠檬酸)
Ka1=7.4×10-4
Ka2=1.7×10-5
Ka3=4.0×10-7
下列有关推断正确的是( )
A. 溶液pH的大小关系为K3PO4>K2HPO4>KH2PO4
B. 在Na2CO3溶液中存在:c(OH-)- c(H+)=c(HCO3-)+ c(H2CO3)
C. 等浓度的NaHCO3、NaHC2O4溶液中前者pH较大
D. H3C6H5O7与Na2CO3溶液反应的产物为Na3C6H5O7、CO2、H2O
难度: 中等查看答案及解析
-
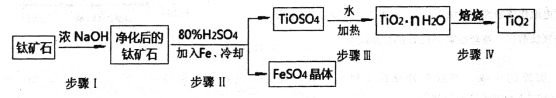
NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是( )
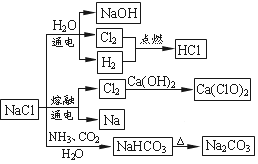
A. 用Cl2制备漂白粉时,是将Cl2通入到石灰水中
B. 由氯化钠制备纯碱的过程中,利用了物质溶解度的差异
C. 常温下干燥Cl2能用钢瓶贮运,所以Cl2不与铁反应
D. 图中所示转化反应都是氧化还原反应
难度: 简单查看答案及解析