-
把0.02mol/L CH3COOH溶液和0.01mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A. c(CH3COO﹣)<c(Na+)
B. c(CH3COOH)>c(CH3COO-)
C. 2c(H+)=c(CH3COO﹣)﹣c(CH3COOH)
D. c(CH3COOH)+c(CH3COO﹣)=0.01mol/L
难度: 困难查看答案及解析
-
下列判断全部正确的一组是:( )
A
B
C
D
强电解质
NaCl
H2SO4
CaF2
石墨
弱电解质
HF
BaSO4
HClO
NH3·H2O
非电解质
Cl2
CS2
CCl4
蔗糖
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列事实可用勒夏特列原理解释的是( )
A. 使用催化剂有利于加快合成氨反应的反应速率
B. H2、I2(g)、HI平衡混合气体加压后颜色变深
C. 500℃左右比在室温时更有利于提高合成氨的转化率
D. 配制氯化铁溶液时,将氯化铁固体溶于浓盐酸中,然后加水稀释
难度: 中等查看答案及解析
-
下列说法正确的是
A. 以下生活常见物质的pH由小到大的顺序为:洁厕灵<白糖水<厨房清洁剂
B. 泡沫灭火器内的成分是苏打溶液和硫酸铝溶液
C. 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到Fe2O3
D. 将光亮Mg条放入盛有氯化铵溶液的试管中,产生的气体只有H2
难度: 困难查看答案及解析
-
下列溶液一定呈中性的是( )
A. pH=7的溶液 B. c(H+)=c(OH-)的溶液
C. 由强酸、强碱等物质的量反应得到的溶液 D. 非电解质溶于水得到的溶液
难度: 中等查看答案及解析
-
当水发生如下变化时:H2O(s)→H2O(l)→H2O(g),此过程的△S(熵变)判断正确的是
A. >0 B. <0 C. 不变 D. 无法判断
难度: 简单查看答案及解析
-
下列式子属于水解反应,且溶液呈酸性的是 ( )
A. HCO3- + H2O
H3O+ + CO32- B. Fe3+ + 3H2O
Fe(OH)3 + 3H+
C. HS- + H2O
H2S + OH- D. NH4+ + OH-
NH3↑+ H2O
难度: 简单查看答案及解析
-
在C(s)+CO2(g)=2CO(g)反应中,可使反应速率增大的措施是
①增大压强 ②增加炭的量 ③通入CO2 ④恒压充入N2 ⑤恒容充入N2 ⑥升温
A. ①③⑥ B. ①③④ C. ②④⑥ D. ③⑤⑥
难度: 中等查看答案及解析
-
参照反应Br+H2
HBr+H的反应历程示意图,下列叙述中正确的是
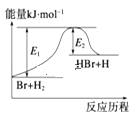
A. 该反应的反应热△H=E2﹣E1
B. 正反应为吸热反应
C. 吸热反应一定要加热后才能发生
D. 升高温度可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
前国际空间站处理CO2废气涉及的反应为CO2+4H2
CH4+2H2O。该反应的下列说法正确的是
A. 通过使用钌催化剂能使CO2 100%转化为CH4
B. 该温度下,当反应达平衡时,CH4物质的量就不再变化,因为反应已经停止
C. 除了使用催化剂,升高温度或增大压强都能加快该反应的速率
D. 由于升高温度可以加快反应速率,所以在工业生产中该反应温度越高越好
难度: 中等查看答案及解析
-
用蒸馏水逐步稀释0.2 mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )
A.c(OH-) B.c(NH4+) C.c(NH3·H2O) D.c(NH4+)/c(NH3·H2O)
难度: 中等查看答案及解析
-
下列反应中符合下列图像的是
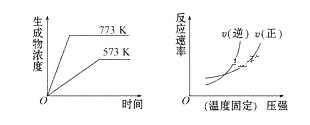
A. N2(g)+3H2(g)
2NH3(g) ΔH=-Q1 kJ/mol(Q1>0)
B. 2SO3(g)
2SO2(g)+O2(g) ΔH=+Q2 kJ/mol(Q2>0)
C. 4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH=-Q3 kJ/mol(Q3>0)
D. H2(g)+CO(g)
C(s)+H2O(g) ΔH=+Q4 kJ/mol(Q4>0)
难度: 简单查看答案及解析
-
下列说法正确的是
A. 某温度下纯水pH=6,则在该条件下pH=4的醋酸和pH=10的NaOH中水的电离程度相同
B. NH4Cl在D2O溶液中水解的离子方程式:NH4++D2O
NH3·D2O+H+
C. 已知S的燃烧热为Q kJ/mol,则S(s)+3/2O2(g)=SO3(g) ΔH=-Q kJ/mol
D. 水的自偶电离方程式:2H2O
H3O++OH-,则液氨自偶电离方程式:2NH3
NH4++NH2-
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是
A. pH=4的0.1mol/LNaHC2O4溶液c(HC2O4﹣)>c(H+)>c(H2C2O4)>c(C2O42﹣)
B. Na2CO3溶液中:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
C. Na2S 溶液中 c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
D. 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,溶液中离子浓度的大小顺序:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
难度: 中等查看答案及解析
-
下图表示溶液中c(H+)和c(OH﹣)的关系,下列判断错误的是
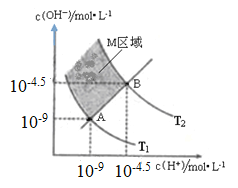
A. 两条曲线间任意点均有c(H+)×c(OH﹣)=KW
B. M区域内任意点均有c(H+)<c(OH﹣)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
难度: 中等查看答案及解析
-
汽车尾气净化器中发生的反应为 2NO(g)+2CO(g) ⇌ N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L的恒容密闭容器中发生上述反应,测得有关实验数据如表:下列说法正确是
容器
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
NO
CO
N2
CO2
N2
CO2
I
400
0.2
0.2
0
0
0.12
II
400
0.4
0.4
0
0
III
300
0
0
0.1
0.2
0.075
A. 该反应的△S<0、△H>0
B. 容器I中达到平衡所需时间2s,则v(N2)=0.06mol/(L·s)
C. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时v(正)>v(逆)
D. 达到平衡时,体系中c(CO)关系: c(CO,容器Ⅱ) >2 c(CO,容器Ⅰ)
难度: 中等查看答案及解析
