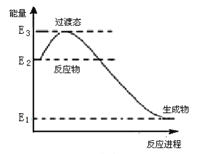
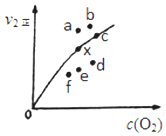
-
水是生命之源,下列有关说法中正确的是( )
A. 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染
B. 氯水放置数天后,漂白性和酸性均减弱
C. 氨水能导电,说明氨气是电解质
D. 王水是浓盐酸和浓硝酸按体积比3:1配成的混合物,可以溶解Au、Pt
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法不正确的是
A. 1LpH=3的盐酸与1LPH=3的CH3COOH溶液中,水电离出的H+数目均为10-11NA
B. 0.1mol乙烯与乙醇的混合物中含碳原子数为0.2 NA
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.1NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数小于0.2mol
难度: 中等查看答案及解析
-
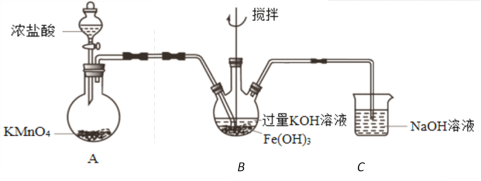
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3。下列说法正确的是
A. 制取NF3的反应中,氧化剂与还原剂的物质的量之比为3∶1
B. 在NF3与H2O的反应中,H2O作还原剂
C. 若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol
D. NF3在空气中一旦泄漏,不易于发现
难度: 困难查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
测定醋酸钠溶液pH
B
向盐酸中滴入少量NaAlO2溶液
无明显现象
AlO2-与H+未发生反应
C
用铂丝蘸取少量某溶液进行焰色反应
火焰呈黄色
该溶液一定是钠盐溶液
D
蘸有浓氨水的玻璃棒靠近某溶液
有白烟产生
该溶液可能是浓盐酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
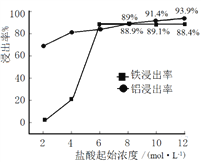
四种短周期主族元素在周期表中的位置如图,则下列说法错误的是
A. 若Y的最简单氢化物的沸点比M的低,则X单质可与强碱溶液反应
B. 简单阴离子半径M>Z>Y
C. 若Y的氢化物水溶液呈碱性,则X的氧化物不与任何酸反应
D. 最高价氧化物对应水化物的酸性Z>M
难度: 中等查看答案及解析
-
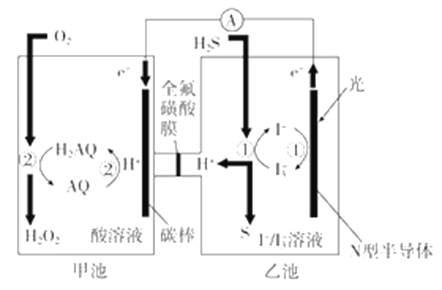
通过膜电池可除去废水中的乙酸钠和对氯苯酚(
 ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是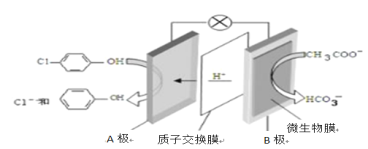
A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:

D. 当外电路中有0.2mol e- 转移时,A极区增加的H+ 的数目为0.1NA
难度: 困难查看答案及解析
-
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是( )。
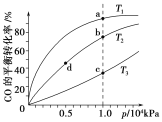
A. 温度:T1>T2>T3
B. 正反应速率:v(b)>v(d) v(a)>v(c)
C. 平衡常数:K(a)>K(c) K(b)=K(d)
D. 平均摩尔质量:M(b)>M(d) M(a)<M(c)
难度: 困难查看答案及解析