-
空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
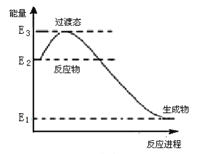
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
I.2NO(g)⇌N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)⇌2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________。
②决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
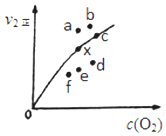
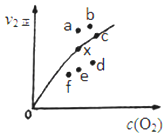
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____(填字母)。
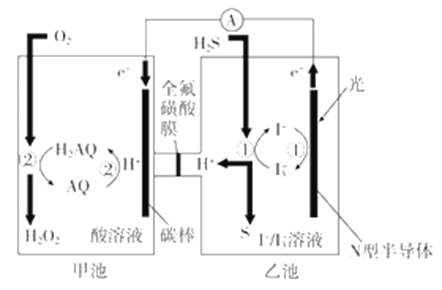
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
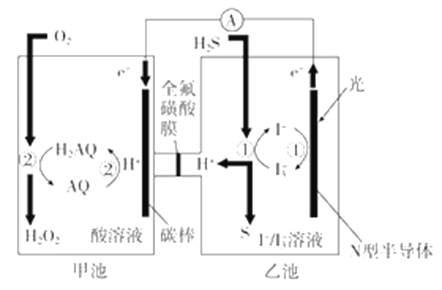
已知甲池中发生的反应为:
①装置中H+从__________ 移向__________(填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________。
-
空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)
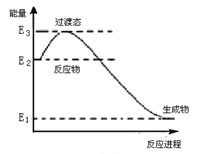
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
I.2NO(g)⇌N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)⇌2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________。
②决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____(填字母)。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
已知甲池中发生的反应为: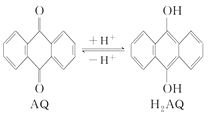
①装置中H+从__________ 移向__________(填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________。
-
空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)

(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
I.2NO(g)⇌N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)⇌2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________。
②决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
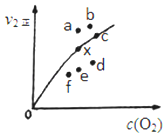
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____(填字母)。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
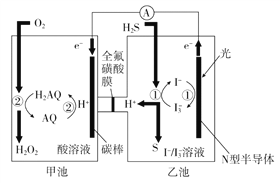
已知甲池中发生的反应为: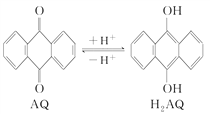
①装置中H+从__________ 移向__________(填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________。
-
空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3和CO等物质。
(1)烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点。
选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=﹣905.5kJ/mol
N2(g)+O2(g)=2NO(g) △H= +180kJ/mol
则4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H=________
②在催化剂作用下,尿素[CO(NH2)2]也可以将NOx反应生成N2和H2O。写出CO(NH2)2与NO2反应的化学方程式_____________________。
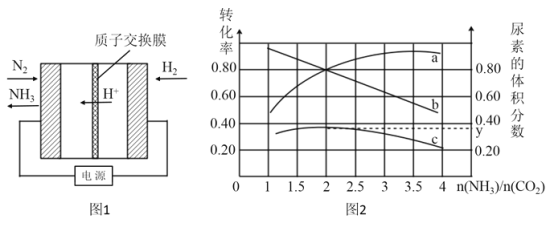
(2)电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应是_____________。
(3)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]=___________时,尿素产量最大;经计算,图中y=____________(精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]=___________时,尿素产量最大;经计算,图中y=____________(精确到0.01)。
(4)废水中含氮化合物的处理方法有多种。
①用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是__________。
②用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH_________(填“升高”、“降低”或“不变”)。
-
空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3和CO等物质。
(1)烟气的脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点。
选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=﹣905.5kJ/mol
N2(g)+O2(g)=2NO(g) △H= +180kJ/mol
则4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H=
②在催化剂作用下,尿素[CO(NH2)2]也可以将NOx反应生成N2和H2O。写出CO(NH2)2与NO2反应的化学方程式 。
(2)电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应是 。
(3)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(4)废水中含氮化合物的处理方法有多种。
①用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是__________。
②用H2催化还原法可降低水中NO 的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
-
空气质量评价的主要污染物为PM 10、PM2.5、SO2、NO2、O3、CO等物质。烟气的脱硝(除NOx)
技术和脱硫(除SO2)技术都是环境科学研究的热点,选择性催化还原法(SCR)是目前最成熟的烟气脱硝技术,即在催化剂的作用下,用还原剂选择性地与NOx反应生成N2和H2O。
(1)在催化剂存在的条件下,用H2将NO还原为N2。已知:

则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_____________。
(2)用热炭还原NO的反应为2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为T1℃、T1℃、T2℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为T1℃、T1℃、T2℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 | 200 |
| n(NO) /mol(甲容器/T1℃) | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 | 0. 80 |
| n(NO) /mol(乙容器/T1℃) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 | 0.40 |
| n(NO) /mol(丙容器/T2℃) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 | 1.00 |
①该反应T1_________T2,∆H________0 (填“<”或“>”)。
②若乙容器在200min达到平衡状态,则0~ 200min内用CO2的浓度变化表示的平均反应速率v(CO2)=____。
(3)用焦炭还原NO2的反应为2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图18所示:
N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图18所示:
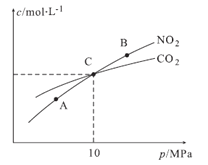
①A、B两点的浓度平衡常数关系:Kc(A)__________ (填“<” 、“>” 或“=”)
②A、B、C三点中NO2的转化率最低的是________(填“A” 、“B” 或“C”)点。
③计算C点时该反应的压强平衡常数Kp(c)=___________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)在催化剂的作用下,尿素可以与NO2反应生成N2、H2O和CO2。写出CO(NH2)2与NO2反应的化学方程式:___________。
(5)氮的化合物应用广泛。氯胺(NH2Cl)是常用的饮用水二级消毒剂,可作长效缓释消毒剂,已知NH2Cl易水解生成强氧化性的物质,写出NH2Cl与水反应的化学方程式:_______________。
-
空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3和CO等物质.其中,NO2与SO2都是形成酸雨的主要物质.在一定条件下,两者能发生反应:NO2(g)+SO2(g)⇌SO3(g)+NO(g)
完成下列填空:
(1)在一定条件下,将等物质的量的NO2、SO2气体置于体积固定的密闭容器中发生反应,下列能说明反应已经达到平衡状态的是______.
a.v(NO2)生成=v(SO2)消耗 b.混合物中氧原子个数不再改变
c.容器内气体颜色不再改变 d.容器内气体平均相对分子质量不再改变
(2)当空气中同时存在NO2与SO2时,SO2会更快地转变成H2SO4,其原因是______.
(3)科学家正在研究利用催化技术将NO2和CO转变成无害的CO2和N2,反应的化学方程式:2NO2(g)+4CO(g) 4CO2(g)+N2(g)+Q(Q>0),若在密闭容器中充入NO2和CO,下列措施能提高NO2转化率的是______.
4CO2(g)+N2(g)+Q(Q>0),若在密闭容器中充入NO2和CO,下列措施能提高NO2转化率的是______.
A.选用高效催化剂 B.充入NO2C.降低温度 D.加压
(4)请写出N原子最外层电子轨道表达式______,写出CO2的电子式______.
(5)关于S、N、O、C四种元素的叙述正确的是______.
A.气态氢化物均为极性分子 B.最高化合价均等于原子最外层电子数
C.单质一定为分子晶体 D.原子最外层均有两种不同形状的电子云
(6)写出一个能够比较S元素和C元素非金属性强弱的化学反应方程式:______.
-
研究发现,含Pm2.5的雾霾主要成分有CO2、SO2、NOx、CxHy及可吸入颗粒等。为减少雾霾要进行脱硝、脱硫、脱碳,请回答下列问题:
(1)脱硝。为消除NOx对环境的污染,利用NH3在一定条件下与NO反应生成无污染气体。
已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ/mol
4NO(g)+6H2O(g) △H=-905kJ/mol
N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
①NH3(g)与NO(g)在一定条件下反应的热化学方程式为:______________________。
②下图是①中反应过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是___________,原因是___________。

(2)脱硫。下图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4。
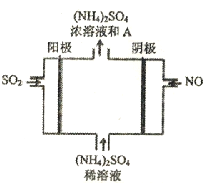
①装置中发生反应的化学方程式为___________。
②阴极的电极反应式是___________。
③某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为___________;常温下,在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)___________c(NO3-)(填写“>”“=”或“<”)。
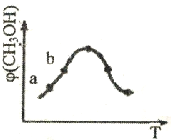
(3)脱碳。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H 取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数
CH3OH(g)+H2O(g) △H 取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数 (CH3OH)与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H=___________0(填“>”“<”或“=”)。请解释b比a纵坐标大的原因___________。
(CH3OH)与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H=___________0(填“>”“<”或“=”)。请解释b比a纵坐标大的原因___________。
-
(8分)PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx 等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5试样的pH 。
(2)NOx 汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
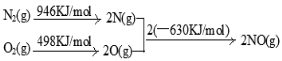
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
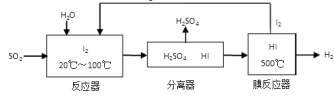
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _。
-
Ⅰ(8分)PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx 等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5试样的pH 。
(2)NOx 汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
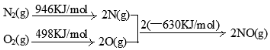
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
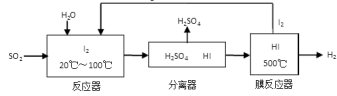
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_ _
Ⅱ(10分)铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
(1)检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
(2)将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
(3)由滤液B制备氯化铝晶体涉及的操作为: 蒸发浓缩、冷却结晶、 、洗涤。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。