-
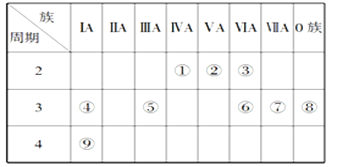
W、R、X、Y、Z是原子序数依次增大的短周期主族元素。Y原子半径在短周期主族元素中最大。W与Y同主族,X与Z同主族。R原子最外层电子数比内层电子数多3,W、Y原子的电子数总和与X、Z原子的电子数总和之比为1∶2。下列说法正确的是
A. 原子半径: r(Z)>r(X)>r(R)>r(W)
B. X与Y形成化合物中可能既有离子键又有共价键
C. X的简单气态氢化物的热稳定性比Z的弱
D. 由W、R、X三种元素组成的化合物只能是酸或碱
难度: 困难查看答案及解析
-
将Na、Mg、Al各0.3mol分别放入100mL 1mol/L的HCl中,同温同压下产生的气体的体积比是
A. 3:1:1 B. 6:3:2 C. 1:2:3 D. 1:1:1
难度: 中等查看答案及解析
-
某溶液中含有下列六种离子:①HCO3- ②SO32- ③K+ ④CO32- ⑤NH4+ ⑥NO3-,向其中加入稍过量Na2O2后,溶液中离子浓度基本保持不变的是
A. ③⑥ B. ④⑥ C. ③④⑥ D. ①②⑤
难度: 简单查看答案及解析
-
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。那么,这种做法的化学原理是
A. 胶体的电泳 B. 血液的氧化还原反应
C. 血液中发生复分解反应 D. 胶体的聚沉
难度: 中等查看答案及解析
-
下列物质分类正确的是
A. SO2、SiO2、NO2均为酸性氧化物
B. 盐酸、水玻璃、氨水均为混合物
C. 烧碱、冰醋酸、蔗糖均为电解质
D. 稀豆浆、鸡蛋清溶液、氯化铁溶液均为胶体
难度: 中等查看答案及解析
-
配制一定物质的量浓度的Na2CO3溶液,下列操作正确的是
A. 称量时,将Na2CO3固体直接放在托盘天平的右盘上
B. 将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D. 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
难度: 简单查看答案及解析
-
下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是




A.甲醇低温所制氢气用于新能源汽车
B.氘、氚用作“人造太阳”核聚变燃料
C.偏二甲肼用作发射“天宫二号”的火箭燃料
D.开采可燃冰,将其作为能源使用
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质属于弱电解质的是
A. 二氧化碳 B. 醋酸钠 C. 氢氧化钙 D. 水
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法错误的是( )
A. PM2.5是指粒径不大于2.5 μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
难度: 中等查看答案及解析
-
下列物质互为同素异形体的一组是
A. 35Cl和37Cl B. H2和D2
C. O2和O3 D. 乙烯和丙烯
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A. H2SO4的摩尔质量是98
B. 等质量的O2和O3中所含的氧原子数相同
C. 等质量的CO与CO2中所含碳原子数之比为7︰11
D. 98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
难度: 简单查看答案及解析
-
将下列各种液体分别与溴水混合并振荡,静置后混合液分为两层,下层几乎无色的是
A. 苯 B. 碘化钾溶液 C. CCl4 D. 水
难度: 简单查看答案及解析
-
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
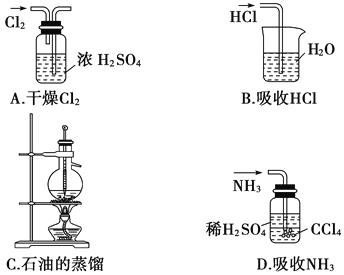
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. 羟基的电子式:
B. 中子数为16的磷原子:31P
C. 乙烯的结构简式:CH2CH2 D. HClO的结构式:H-Cl-O
难度: 中等查看答案及解析
-
下列变化符合如下图示的是
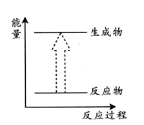
①冰雪融化 ②KMnO4分解制O2 ③铝与氧化铁的反应 ④钠与水反应 ⑤二氧化碳与灼热的木炭反应 ⑥碘的升华⑦Ba(OH)2·8H2O和NH4Cl的反应
A. ②⑥⑦ B. ②⑤⑦ C. ①②⑤⑥⑦ D. ③④
难度: 中等查看答案及解析
-
将标准状况下的V LHCl(气)溶于1000g水中,得到的盐酸密度为g/cm3,则该盐酸的物质的量浓度为
A. 1000Vρ/(22400+36.5V)mol/L B. Vρ/22400mol/L
C. Vρ/(22400+36.5V)mol/L D. V/22.4mol/L
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法中正确的是
A. 常温下,23gNO2和N2O4的混合气体中含有NA个氧原子
B. 0.5mol 氯气与足量的氢氧化钠溶液反应电子转移总数为NA
C. 1L0.5mol/LFeCl3溶液完全转化可制得0.5NA个Fe(OH)3胶粒
D. 标况下11.2LH2O与4.0gCH4所含氢原子个数均为NA
难度: 中等查看答案及解析
-
下列反应中前者属于取代反应,后者属于加成反应的是
A. 甲烷与氯气混和后光照反应;乙烯使酸性高锰酸钾溶液的褪色
B. 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷
C. 在浓硫酸作用下,苯在55℃左右与浓硝酸的反应; 乙烯与水生成乙醇的反应
D. 在苯中滴入溴水,溴水褪色; 乙烯自身生成聚乙烯的反应
难度: 中等查看答案及解析
-
若加入铝粉能放出氢气的溶液中分别加入下列各组离子,可能共存的是
A. NH4+、NO3-、CO32-、Na+ B. Na+、Ba2+、Mg2+、HCO3-
C. SO42-、Mg2+、K+、Cl- D. Fe2+、K+、AlO2-、NO3-
难度: 困难查看答案及解析
-
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
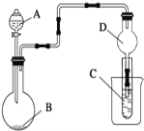
A. 若A为浓H2SO4,B为Na2SO3,C中盛有Na2SiO3溶液,C中溶液出现白色沉淀,证明非金属性S>Si
B. 若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C. 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,C中先产生白色沉淀后沉淀又溶解
D. 若A为H2O2,B为MnO2,C中盛有Na2S溶液,C中溶液变浑浊
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 向Na2CO3溶液中通入过量CO2气体:CO32- + CO2 + H2O = 2HCO3-
B. 氯气与水的反应:Cl2 + H2O = 2H+ + Cl- + ClO-
C. 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
D. 氯化铝溶液中加入过量氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
难度: 中等查看答案及解析
-
某原电池总反应的离子方程式为:2Fe3++ Fe=3Fe2+,能实现该反应的原电池是
A. 正极为铜,负极为铁,电解质溶液为FeCl2溶液
B. 正极为C,负极为铁,电解质溶液为FeCl3溶液
C. 正极为铁,负极为锌,电解质溶液为Fe2(SO4)3
D. 正极为银,负极为铁,电解质溶液为CuSO4溶液
难度: 中等查看答案及解析
-
一定温度下,把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(s)
xC(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D,下列叙述中不正确的是
A. 反应达到平衡状态时A的转化率为60%
B. x=4
C. 反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6∶5
D. 若混合气体的密度不再变化,则该可逆反应达到化学平衡状态
难度: 困难查看答案及解析
-
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示。则甲和X不可能是

A. 甲为C,X为O2
B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2
D. 甲为AlCl3溶液,X为NaOH溶液
难度: 中等查看答案及解析
-
对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
难度: 困难查看答案及解析