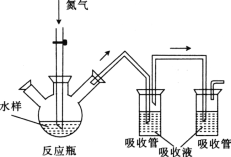
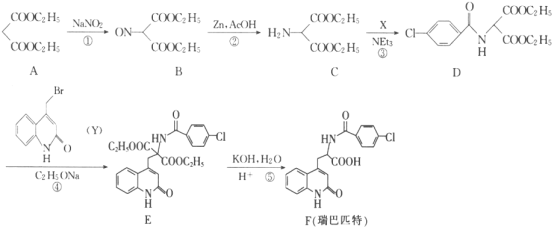
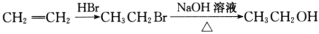-
中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列常见古诗文记载对应的化学知识不正确的是
选项
常见古诗文记载
化学知识
A
《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”
黄芽为硫黄
B
《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛。”
强水为硝酸
C
《九转流珠神仙九丹经》中生砒精制砒霜的记载:“其色飘飘或如霜雪,或如白色钟乳相连。”
利用了蒸馏操作
D
《本草经集注》中鉴别硝石(KNO3)和朴消(Na2SO4)的方法:“强烧之,紫青烟起,乃真硝石也。”
利用了焰色反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
乙烯酮的结构简式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到。下列说法不正确的是
A. 1mol乙烯酮与1molH2完全反应生成1mol乙醇
B. 乙烯酮中所有的原子均处于同一平面内
C. 乙烯酮与水反应生成乙酸的反应属于加成反应
D. 乙烯酮与
互为同分异构体
难度: 中等查看答案及解析
-
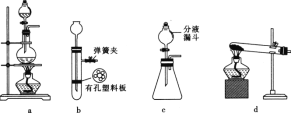
1,2-二溴乙烷(沸点为131℃),可溶于CCl4,某同学在实验室将乙烯通入溴的四氯化碳溶液中,在生成和纯化1,2-二溴乙烷的实验过程中,下列操作未涉及的是
A.
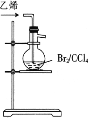 B.
B. 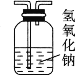 C.
C. 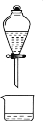 D.
D. 
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. CaCO3溶于CH3COOH溶液中:CaCO3+2H+=Ca2++CO2↑+H2O
B. 向AlCl3溶液中通入过量NH3:Al3++4OH—=
+2H2O
C. 过量的铁和稀硝酸反应:Fe+
+4H+=Fe3++NO↑+2H2O
D. 向KAl(SO4)2溶液中滴入Ba(OH)2溶液使
恰好完全沉淀:

难度: 中等查看答案及解析
-
在含Fe3+的
和I-的混合溶液中,反应
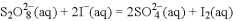 的分解机理及反应进程中的能量变化如下:
的分解机理及反应进程中的能量变化如下: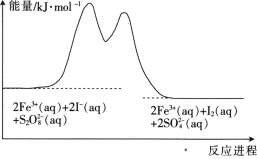
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:
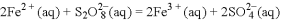
下列有关该反应的说法正确的是
A. 反应速率与Fe3+浓度有关
B. 该反应为吸热反应
C. v(
)=v(I-)=v(I2)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是
A. 离子化合物YX4W溶于水后,得到的溶液呈碱性
B. 化合物YW3为共价化合物,电子式为
C. Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D. 工业上常用电解Z与W形成的化合物的方法制取单质Z
难度: 中等查看答案及解析
-
常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
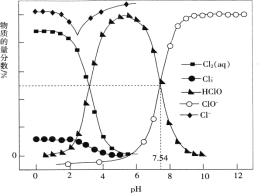
A. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
B. 常温下反应Cl2(aq)+Cl-(aq)
(aq)的K=0.191,当pH增大时,K减小
C. pH=1的氯水中,c(Cl2)>c(
)>c(HClO)>c(ClO-)
D. 该温度下,HClO
H++ClO-的电离常数Ka的对值lgKa=-7.54
难度: 困难查看答案及解析