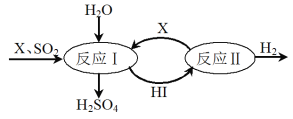
-
景泰蓝是一种传统的手工艺品。下列制作景泰蓝的步骤中,不涉及化学变化的是
A
B
C
D

将铜丝压扁,掰成图案

将铅丹、硼酸盐等化合熔制后描绘
高温焙烧
酸洗去污A. A B. B C. C D. D
难度: 简单查看答案及解析
-
当光束通过下列物质时,能观察到丁达尔效应的是
A. CuSO4溶液 B. 蔗糖溶液 C. NaOH溶液 D. Fe(OH)3胶体
难度: 简单查看答案及解析
-
下列物质属于电解质的是
A. 稀盐酸 B. 二氧化碳 C. 氯化钠 D. 铁
难度: 简单查看答案及解析
-
在盛装氢氧化钠固体和浓硫酸的试剂瓶上,都印有的警示标志是
A
B
C
D




A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列物质中,常用作氧化剂的是
A. KMnO4 B. H2 C. Na D. H2O
难度: 简单查看答案及解析
-
下列电离方程式的书写,正确的是
A. NH3·H2O==NH4+ + OH― B. H2SO4==2H+ + SO42―
C. CuCl2== Cu2+ + Cl― D. NaHCO3==Na+ + H+ + CO32―
难度: 简单查看答案及解析
-
已知3.01×1023个X气体分子的质量为32g,则X气体的摩尔质量是( )
A. 16g B. 32 C. 64g /mol D. 32g /mol
难度: 简单查看答案及解析
-
下列反应中,不属于氧化还原反应的是
A. 2Na + 2H2O =2NaOH + H2↑ B. 2Na + O2
Na2O2
C. 2Na2O2 + 2CO2=2Na2CO3+O2 D. NaHCO3+HCl=NaCl+H2O+CO2↑
难度: 简单查看答案及解析
-
下列各组溶液相互混合后,不会发生离子反应的是
A. NaOH和Fe2(SO4)3 B. Na2CO3和稀硫酸
C. Na2SO4和CuCl2 D. Mg(OH)2和稀盐酸
难度: 简单查看答案及解析
-
下列化学方程式中,不能用离子方程式Ba2++SO42―=BaSO4↓表示的是
A. BaCl2+H2SO4= BaSO4↓+ 2HCl
B. Ba(OH)2+H2SO4=BaSO4↓+ 2H2O
C. Ba(NO3)2+CuSO4=Cu(NO3)2 + BaSO4↓
D. Ba(OH)2+Na2SO4=BaSO4↓+ 2NaOH
难度: 简单查看答案及解析
-
下列实验装置及操作不能达到实验目的的是
A. 配制一定物质的量浓度的溶液
B. 除去CuCl2溶液中的FeCl2
C. 从食盐水中获取氯化钠
D. 分离植物油和水
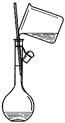

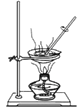

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
实验室用足量的锌粒和100mL稀硫酸制备氢气,当收集到标准状况下1.12L H2时,反应停止,下列说法不正确的是
A. 稀硫酸中H+的浓度是0.5mol/L B. 消耗硫酸物质的量是0.05 mol
C. 消耗锌的质量是3.25g D. 氢气中可能混有水蒸气
难度: 简单查看答案及解析
-
下列各组物质分类的组合,正确的是
酸
碱
盐
碱性氧化物
A
硫酸
纯碱
胆矾
氧化钠
B
硝酸
烧碱
硫酸钾
氧化钙
C
醋酸
一水合氨
苛性钠
氧化铁
D
碳酸
熟石灰
小苏打
二氧化碳
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
将4gNaOH固体完全溶解在水里,配成100mL溶液,从中取出10mL,加水稀释至50mL,所得溶液的物质的量浓度是
A. 1mol/L B. 0.1 mol/L C. 0.2 mol/L D. 0.02 mol/L
难度: 简单查看答案及解析
-
下列离子方程式中,正确的是
A. 稀硫酸滴在铜片上:Cu + 2H+ == Cu2+ + H2O
B. 少量二氧化碳通入澄清石灰水:Ca2+ + 2OH― + CO2 == CaCO3↓ + H2O
C. 氯化铁溶液中加入铁粉:Fe3+ + Fe == 2Fe2+
D. 碳酸钡与稀盐酸混合:CO32― + 2H+== CO2↑+ H2O
难度: 简单查看答案及解析
-
科学家发现了利用泪液来检测糖尿病的方法,其原理是用氯金酸钠(NaAuCl4)溶液与溶液中的葡萄糖发生反应生成纳米金单质颗粒(直径为20-60nm)。下列有关说法错误的是
A. 氯金酸钠中金元素的化合价为+3
B. 葡萄糖在反应中体现还原性
C. 检测时,NaAuCl4发生氧化反应
D. 纳米金单质颗粒分散在水中所得的分散系属于胶体
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下,18g H2O 的体积约为22.4 L
B. 28 g N2和CO的混合气含有的分子数为NA
C. 1 mol CH4中含有的质子数约为6.02×1023
D. 同温同压下,体积相同的氧气和氨气含有相同个数的原子
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A. 使酚酞试液变红的溶液:Na+、Cl―、SO42―、Fe3+
B. 碳酸氢钠溶液:K+、SO42―、Cl―、OH―
C. 某无色的溶液:K+、Ba2+、Cl―-、MnO4―
D. 使紫色石蕊试液变红的溶液:Fe3+、Mg2+、NO3―、Cl―
难度: 中等查看答案及解析
-
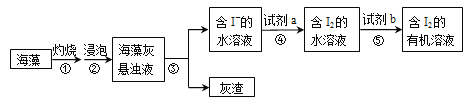
某未知溶液可能含Cl―、CO32―、Na+、SO42―、Mg2+,取少量试液,滴加紫色石蕊试液,溶液变红。另取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断不合理的是
A. 一定有Cl― B. 一定有SO42―
C. 可能有Mg2+ D. 一定没有CO32―
难度: 中等查看答案及解析
-
常温下,发生下列几个反应:
①16H+ + 10Z― + 2XO4―== 2X2+ + 5Z2 + 8H2O
②2A2+ + B2 == 2A3+ + 2B―
③2B― + Z2 == B2+ 2Z―
根据上述反应提供的信息,判断下列结论不正确的是
A. 氧化性:XO4―>B2>A3+ B. X2+既有还原性,又有氧化性
C. 还原性:Z―> A2+ D. 溶液中可发生:Z2 + 2A2+ == 2A3++ 2Z―
难度: 中等查看答案及解析
-
某离子反应涉及H2O、Cr2O72―、NO2―、H+、NO3―、Cr3+六种微粒,已知反应过程中NO2-浓度变化如图所示,下列说法不正确的是
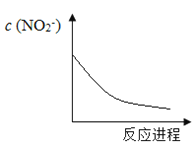
A. Cr2O72-中Cr化合价是+6价
B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol
D. 随着反应的进行,溶液中的H+ 浓度增大
难度: 中等查看答案及解析