-
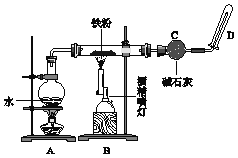
某无色溶液含有下列离子中的若干种:H+、NH4+、Cu2+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
A. 硅胶可用作食品干燥剂
B. P2O5不可用作食品干燥剂
C. 六水合氯化钙可用作食品干燥剂
D. 加工后具有吸水性的植物纤维可用作食品干燥剂
难度: 简单查看答案及解析
-
下图分别表示四种操作,其中有两处错误的是
A. 读数
 B. 稀释
B. 稀释
C. 称量
 D. 溶解
D. 溶解
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100 g质量分数为46%的乙醇(C2H6O)水溶液中含有的氧原子数为4NA
B. 2 mol Cu与100 mL浓度为18.4 mol·L−1的浓硫酸在加热条件下充分反应,生成SO2分子数为0.92NA
C. 0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
D. 0.1 mol/L的Ba(OH)2溶液中,OH−的个数为0.2NA个
难度: 简单查看答案及解析
-
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
①2Na2O2+2H2O=4NaOH+O2↑;②2F2+2H2O=4HF+O2;③4NO2+O2+2H2O=4HNO3;④2Na+2H2O=2NaOH+H2↑
A. ①③ B. ②③ C. ③④ D. ②④
难度: 简单查看答案及解析
-
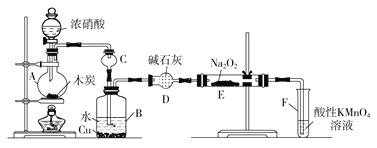
下列离子方程式书写正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + Fe3+ = Cu2+ + Fe2+
B. 向氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
C. Na2O2固体与H2O反应产生O2 :2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
D. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO+4OH-== 2MnO2↓+3SO
+2H2O
难度: 简单查看答案及解析
-
下列物质分类的正确组合是
分类
组合
纯净物
酸
盐
碱性氧化物
酸性氧化物
A
碱石灰
高氯酸
纯碱
氧化铝
二氧化碳
B
盐酸
醋酸
小苏打
氧化镁
二氧化氮
C
H2O2
碳酸
苏打
过氧化钠
二氧化硫
D
五水硫酸铜
硝酸
碱式碳酸铜
氧化钠
三氧化硫
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
A. NaHSO4和Ba(OH)2 B. AlCl3和NaOH
C. Na2CO3和H2SO4 D. NaAlO2和H2SO4
难度: 中等查看答案及解析
-
相同状况下,在容积相同的三个烧瓶内分别充满干燥的HCl、NO2、NH3气体,做喷泉实验,所得三种溶液的物质的量浓度比为
A. 3:3:2 B. 1:1:1 C. 2:2:3 D. 无法比较
难度: 中等查看答案及解析
-
将2.17g Na、Na2O、Na2O2 的混合物与足量的水反应,在标准状况下得到336mL混合气体,将该混合气体通过放电,恰好完全反应。则它们的物质的量之比为
A. 1:1:1 B. 1:1:2
C. 1:2:1 D. 4:3:2
难度: 中等查看答案及解析
-
将气体a通入溶液b中,始终无明显变化的是
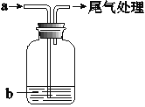
气体a
溶液b
A
Cl2
NaBr
B
CO2
CaCl2
C
SO2
Ba(NO3)2
D
NO2
FeSO4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
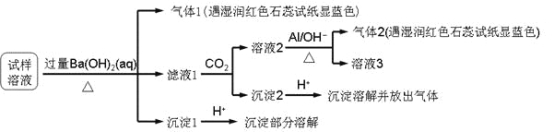
已知:3NO3-+ 8Al + 5OH-+ 2H2O
3NH3↑+ 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
A. 试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B. 试样中可能存在Na+、Cl-
C. 试样中一定不含Al3+
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
难度: 困难查看答案及解析
-
为证明稀硝酸与铜反应产物中气体为NO,设计右下图实验(实验过程中活塞2为打开状态),下列说法中不正确的是
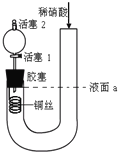
A. 关闭活塞1,加入稀硝酸至液面a处
B. 在装置左侧稍加热可以加速铜的溶解
C. 通过关闭或开启活塞1可以控制反应的进行
D. 反应开始后,胶塞下方有无色气体生成,但不能证明该气体为NO
难度: 中等查看答案及解析
-
在反应5NH4NO3 = 4N2↑+2HNO3+9H2O 中,发生还原反应的氮元素与发生氧化反应的氮元素的物质的量之比为
A. 5:3 B. 3:5
C. 5:4 D. 4:5
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(己知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是
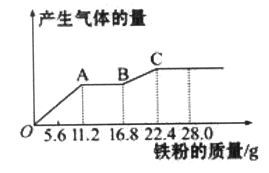
A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中NO3-物质的量为0.4 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20 mL原混合酸加水稀释至1 L后溶液c(H+) =0.1mol • L-l
难度: 困难查看答案及解析