-
《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无砂粘土而为之”,“凡坯既成,干燥之后,则堆积窖中燃薪举火”,“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是
A. 粘土是制作砖瓦和陶瓷的主要原料
B. “燃薪举火”使粘土发生复杂的物理化学变化
C. 沙子和粘土的主要成分均为硅酸盐
D. 烧制后自然冷却成红瓦,浇水冷却成青瓦
难度: 中等查看答案及解析
-
下列实验对应的现象以及结论均正确的是
选项
实验
现象
结论
A
向装有溴水的分液漏斗中加入裂化汽油,充分振荡,静置
上层溶液为橙色
裂化汽油可萃取溴
B
将钠块加入盛有无水乙醇的烧杯中
有气泡产生
生成的气体是H2
C
向Ba(ClO)2溶液中通入SO2
有白色沉淀生成
酸性:H2SO4>HClO
D
分别向相同浓度的ZnSO4溶液和
CuSO4溶液中通入H2S
前者无现象,后者有黑色沉淀生成
Ksp(ZnS)<Ksp(CuS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
中国是中草药的发源地,目前中国大约有12000 种药用植物。从某中草药提取的有机物结构如图所示。下列说法正确的是
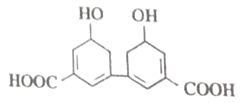
A. 分子式为C14H10O6
B. 环上氢原子的一氯取代物有3种
C. 1mol该有机物与足量NaOH 溶液反应最多消耗4molNaOH
D. 能发生酯化反应和加成反应
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数值。下列说法正确的是
A. 标准状况下,11.2L的甲醇所含的氢原子数等于2NA
B. 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和和溶液中Ba2+数 目 为1×10-5NA
C. 常温常压下,Na2O2 与H2O 反应生成1molO2时,转移电子数是2 NA
D. 1L1mol·L-1 AlCl3溶液中含有的Al3+数目为NA
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
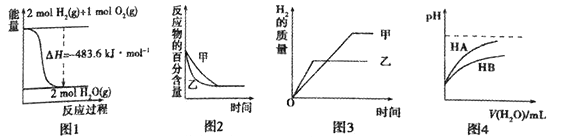
A. 图1表示H2与O2发生反应过程中的能量变化,则H的燃烧热为241.8kJ·mo1-1
B. 图2表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
C. 若图3表示等质量的钾、钠分别与足量水反应,则甲代表钠
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
难度: 中等查看答案及解析
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y 是金属元素,X的焰色反应呈黄色。五种元素的核电荷数之和为54,W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y 的单质,则下列说法不正确的是
A. 原子 半 径:X > Y >Z >Q>W
B. Q和W可形成原子个数比为1:1和1:2的化合物
C. X、Y和Z三种元素的最高价氧化物对应的水化物之间均能两两反应
D. 最高价氧化物对应水化物的酸性:Q>Z
难度: 中等查看答案及解析
-
用0.1mol·L-1的NaOH 溶液滴定40mL0.1mol·L-1H2SO3溶液,所得滴定曲线如下图所示 (忽略混合时溶液体积的变化)。下列叙述不正确的是
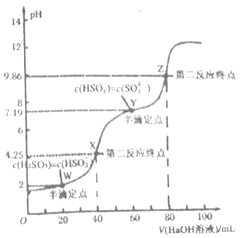
A. H2SO3 的Ka1=1×10-2mol/L
B. 0.05mol·L-1NaHSO3溶液的pH=4.25
C. 图中Y 点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D. 图中Z 点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
难度: 中等查看答案及解析
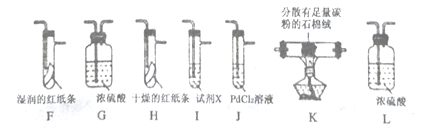
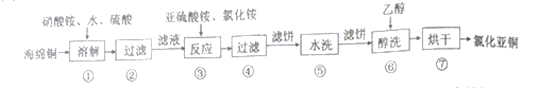
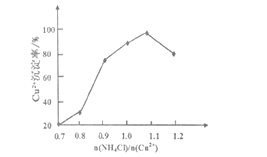
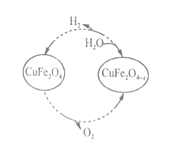
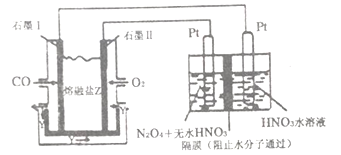
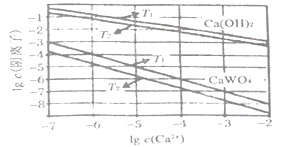
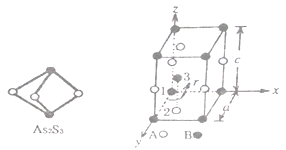
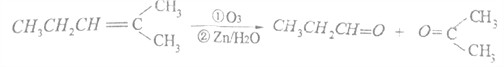
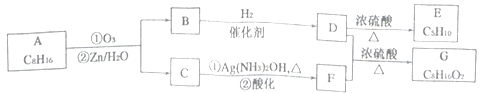
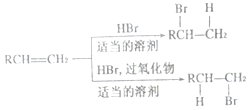 ,请写出由C制备2—丙醇的合成路线_________________。
,请写出由C制备2—丙醇的合成路线_________________。