-
下列实验操作、现象和结论均正确的是
选项
操作
现象
结论
A
向某溶液中加入NaOH 溶液,并将红色石蕊试纸置于溶液中
试纸变蓝
原溶液中有NH4+
B
向苏打和小苏打溶液中分别加入盐酸
均冒气泡
两者均能与盐酸反应
C
向某溶液中滴加氯水后,再加KSCN溶液
溶液变红
该溶液中一定有Fe3+
D
向某无色溶液中滴加BaCl2溶液
产生白色沉淀
该无色溶液中一定含有SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学点亮生活,下列对生活中的化学理解正确的是( )
A. 维生素C能帮助人体将Fe3+转化为易吸收的Fe2+,维生素C具有氧化性
B. 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率
C. 绿色化学要求从源头上减少或消除工业生产对环境的污染
D. 区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察其是否变蓝
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A. 甲烷分子的球棍模型:

B. 中子数为16的硫原子:
C. NaH中氢离子结构示意图为
D. 次氯酸结构式: H-Cl-O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值.下列说法中,正确的是( )
A. 标准状况下,22.4L的NO2和CO2混合气体中含有的氧原子数为4NA
B. 密闭容器中,46gNO2和N2O4的混合气体所含分子个数为NA
C. 常温常压下,22.4L的液态水含有2.24×10﹣8NA个OH﹣
D. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. Fe与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 向NaHSO4溶液中满加Ba(OH)2 至溶液呈中性Ba2++2OH-+2H++S042-=-BaSO4↓+2H2O
C. 向稀H2SO4溶液中滴加Ba(OH)2 溶液.Ba2++OH-+H++SO42-=BaSO4↓+2H2O
D. 向CaCl2 溶液中通人少量的CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
难度: 中等查看答案及解析
-
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
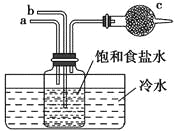
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙呈红色的溶液中:Na+、Ba2+、Cl-、NO3-
B. c( OH-) <
的溶液中:Na+、Ca2+、ClO-、NO3-
C. 含有大量Fe( NO3)2 的溶液中:H+、NH4+、Cl-、SO42-
D. 水电离的c( H+)= 1× 10 -13mol/L的溶液中:K+、Mg2+、Br-、CH3COO-
难度: 困难查看答案及解析
-
H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法正确的是
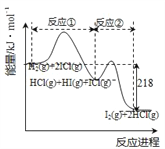
A. 反应①、反应②△H均大于零
B. 反应①、反应②均为氧化还原反应
C. 反应①比反应②的速率慢,与相应正反应的活化能无关
D. 该反应的热反应方程式可表示为:H2(g)+2ICl(g)=I2(g)+2HCl(g) ΔH=-218kJ
难度: 中等查看答案及解析
-
在一定温度下,将H2和I2(g)各0.16mol充入10L恒容密闭容器中,发生反应H2(g)+I2(g)
2HI(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下:
t/min
2
4
7
9
N(I2)/mol
0.12
0.11
0.10
0.10
下列说法不正确的是
A. 反应前4min的平均速率v(HI)=2.5×10-3mol/(L•min)
B. 当体系压强不再改变时可以判断反应达到平衡状态
C. 该温度下此反应的书衡常数K=1.44
D. 再充入0.05molH2、0 .05molI2(g)和0.06molHI,平衡不移动
难度: 中等查看答案及解析
-
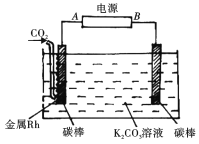
根据光合作用原理,设计如图原电池装置。下列说法正确的是
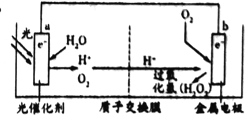
A. a电极为原电池的正极
B. 外电路电流方向是a→b
C. b电极的电极反应为:O2+2e-+2H+=H2O2
D. a电极上每生成1mol O2,通过质子交换膜的H+为2mol
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示物质间的转化均能实现的是
A. 粗硅
SiC14
Si B. NH3
 NO2
NO2HNO3
C. S
SO3
H2SO4 D. Fe2O3
FeCl3 (aq)
Fe
难度: 困难查看答案及解析
-
下列按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合,正确的是
选项
强电解质
弱电解质
酸性氧化物
碱性氧化物
A
Ca(OH)2
酒精
N2O5
Na2O
B
CaSO4
HIO
Mn2O7
CaO
C
NaHCO3
氨水
SO2
Al2O3
D
HCl
HF
CO2
Na2O2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
对于反应3Cl2+6NaOH
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
难度: 中等查看答案及解析
-
石油炼制过程中产生的大量H2S废气的处理设计方案如下图所示,下列说法不合理的是

A. 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B. 电解过程中的阳极可发生的竞争反应主要为:2Cl--2e-=Cl2↑
C. 该工艺流程设计上处理废气H2S的同时也获得产品H2和S
D. 实验室可用点燃充分燃烧的方法消除H2S污染
难度: 困难查看答案及解析
-
PASS 是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X 原子半径最小,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3 倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
A. Z的阳离子与R的阴离子在溶液中因发生氧化还原反应无法共存
B. WY2能与碱反应,但不能与任向酸反应
C. 原子半径按X、Y、R、W、Z的顺序依次增大
D. 熔沸点:X2R >X2Y
难度: 困难查看答案及解析
-
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
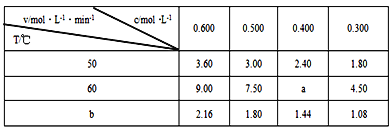
A. a=6.00
B. 同时改变反应温度和蔗糖的浓度,v可能不变
C. b<50
D. 50℃时,经过5s蔗糖浓度减少一半
难度: 困难查看答案及解析