-
常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系正确是( )
A.c(NH4+)<c(Cl-)
B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-)
D.无法确定c(NH4+)与c(Cl-)难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
A.NH4+的水解反应离子方程式:NH4++H2O⇌NH3•H2O+H+
B.在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-=AgI↓
C.镀铜时,阳极的电极反应式为:Cu2++2e-═Cu
D.某反应△H<0,则该反应在任意条件下均可自发进行难度: 中等查看答案及解析
-
下列关于金属的腐蚀说法正确的是( )
A.一般来说,金属发生化学腐蚀的速率比电化学腐蚀速率要快
B.保护地下钢管不受腐蚀,可使它连接直流电源的负极
C.钢铁发生析氢腐蚀时,正极的电极反应式为:2H2O+O2+4e-=4OH-
D.轮船底部放一块锌块,所采用的防腐方法为牺牲阴极的阳极保护法难度: 中等查看答案及解析
-
废电池造成污染的问题日益受到关注.集中处理废电池的首要目的是( )
A.回收石墨电极
B.利用电池外壳的金属材料
C.防止电池中渗泄的电解液腐蚀其他物品
D.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染难度: 中等查看答案及解析
-
强弱电解质的本质区别是( )
A.导电能力
B.化学键的类型
C.电离程度
D.溶解度难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污
B.加热稀醋酸溶液其pH 稍有减小
C.实验室配置FeCl3溶液时,加入少量稀盐酸,以防止溶液浑浊
D.水中加入明矾可以净化水难度: 中等查看答案及解析
-
2010年诺贝尔化学奖授予理查德•海克等三位科学家,以表彰他们在“钯催化交叉偶联”方面的研究.下面关于催化剂的说法正确的是( )
A.催化剂只改变反应的正反应速率
B.催化剂通过升高反应的活化能来加快反应速率
C.催化剂能够改变反应的反应热
D.催化剂不能改变反应物的转化率难度: 中等查看答案及解析
-
如图所示滴定前后滴定管中液面所处的刻度,则消耗溶液的体积为( )

A.V1 mL
B.V2mL
C.(V2-V1)mL
D.(V1-V2)mL难度: 中等查看答案及解析
-
下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.应用盖斯定律可以计算某些难以测量的反应焓变
C.盐类的水解反应是放热反应
D.在吸热反应中,反应物的总能量比产物的总能量高难度: 中等查看答案及解析
-
下列过程中需要通电才可以进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀.
A.①②③
B.②③④
C.②③
D.全部难度: 中等查看答案及解析
-
下列各装置中铜电极上能产生气泡的是( )
A.
B.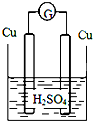
C.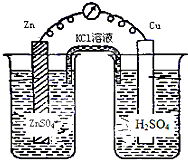
D.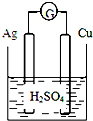
难度: 中等查看答案及解析
-
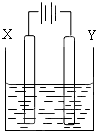
右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
a极板 b极板 X电极 电解质溶液 A 锌 石墨 负极 CuSO4 B 石墨 石墨 负极 NaOH C 银 铁 正极 AgNO3 D 铜 石墨 负极 CuCl2
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
已知水的电离方程式:H2O⇌H++OH-.下列叙述中,正确的是( )
A.升高温度,KW增大,pH不变
B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,KW不变
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低难度: 中等查看答案及解析
-
已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.则该温度下,下列说法正确的是( )
A.在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
B.饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
C.Mg(OH)2固体在20ml0.01 mol•L-1氨水中的Ksp比在20mL 0.01mol•L-1NH4Cl 溶液中的Ksp小
D.在Mg(OH)2的悬浊液加入NaF 溶液后,Mg(OH)2不可能转化成为MgF2难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)⇌2C(g)△H>0,下列图象中正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
用pH试纸测定溶液pH的正确操作是( )
A.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照难度: 中等查看答案及解析
-
有关AgCl的溶解沉淀平衡的说法中,不正确的是( )
A.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度时,AgCl的溶解度增大
D.向AgCl饱和溶液中,加入NaCl固体,会析出AgCl固体难度: 中等查看答案及解析