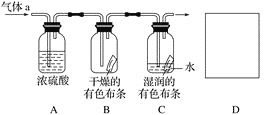
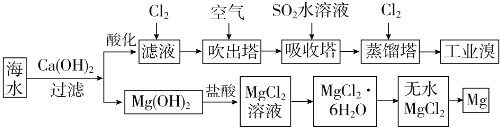
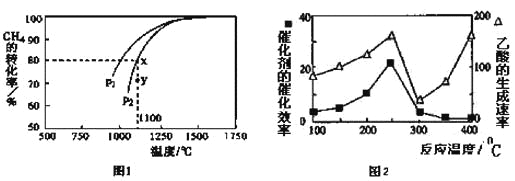
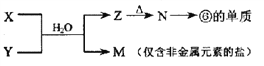-
已知2Fe3++2I-===I2+2Fe2+、2Fe2++Br2===2Br-+2Fe3+。现向含有FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是( )
①氧化性:Br2>Fe3+>I2
②原溶液中Br-一定被氧化
③通入氯气后,原溶液中的Fe2+一定被氧化
④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
A. ①②③④ B. ①③④⑤ C. ②④⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
工业上常利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列有关说法中,错误的是( )
A. 该反应属于氧化还原反应 B. 反应中NH3表现强氧化性
C. 生成1 mol N2有6 mol电子转移 D. 若管道漏气遇氨就会产生白烟
难度: 中等查看答案及解析
-
下列叙述正确的有 ( )
①碱性氧化物:Na2O2、MgO、Al2O3
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2反应、Ba(OH)2·8H2O与NH4Cl反应均既是氧化还原反应,又是吸热反应
⑤碱石灰、生石灰、玻璃、漂白粉、光导纤维都是混合物
⑥苛性钠、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质
A. 1个 B. 2个 C. 3个 D. 4个
难度: 中等查看答案及解析
-
一定条件下,下列不能用勒夏特列原理解释的是( )
A. 合成氨时将氨液化分离,可提高原料的利用率
B. H2、I2、HI 混合气体加压后颜色变深
C. 实验室常用排饱和NaCl溶液的方法收集Cl2
D. 新制氯水中,滴加硝酸银溶液,溶液颜色变浅,产生白色沉淀
难度: 中等查看答案及解析
-
下列各种说法正确的是
①由非金属元素组成的化合物一定是共价化合物
②离子化合物一定含离子键,也可能含共价键
③非极性键既可能存在于单质中,也可能存在于离子化合物或共价化合物中
④金属性越强的元素相应的简单阳离子氧化性一般越弱
⑤含金属元素的化合物不一定是离子化合物
⑥任何元素的原子都是由核外电子和核内中子、质子组成的
⑦化学反应一定伴随着能量的变化
⑧质子数相同的微粒一定属于同种元素
A. ②③④⑤⑦ B. ②③⑤⑦⑧ C. ①③④⑥⑦ D. ①②④⑤⑥
难度: 中等查看答案及解析
-
下列关于反应能量的说法正确的是
A. 若反应A=B △H<0,说明A物质比B物质稳定,分子内共价键键能 A比B大
B. 500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g), 放热 akJ,热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H= -2a kJ•mol-1
C. 101kPa时,2H2(g)+O2(g)==2H2O(g);△H=-QkJ·mol-1,则H2的燃烧热为1/2QkJ·mol-l
D. 化学反应中,吸热反应不一定需要加热也能发生
难度: 中等查看答案及解析
-
氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)
Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增加。W原子最外层电子数是其所在周期数的2倍;Y+和X2-的电子层结构相同;Z的原子序数等于W和Y的核外电子数之和。下列说法正确的是
A. Z的氢化物的酸性比WX2的水化物的强,说明Z的非金属性比W的强
B. 离子半径大小:Z>Y>X
C. X和Y形成的化合物为离子化合物且阳离子和阴离子的个数之比为2:1
D. Z元素的气态氢化物的热稳定性比X的高
难度: 中等查看答案及解析
-
下列各项操作中符合“先出现沉淀后沉淀完全溶解”现象的有( )组
①向饱和碳酸钠溶液中通入CO2 至过量
②向Fe(OH)3胶体中逐滴滴加稀H2SO4至过量
③向BaCl2溶液中通入CO2 至过量
④向澄清石灰水中逐渐通入CO2至过量
⑤向Al2(SO4)3溶液中逐滴滴加Ba(OH)2至过量
⑥向NaAlO2溶液中逐滴滴加盐酸至过量
⑦向NaAlO2溶液中逐渐通入CO2至过量
⑧向溶有氨水的NaCl饱和溶液中逐渐通入CO2至过量
A. 2 B. 3 C. 4 D. 5
难度: 中等查看答案及解析
-
反应A
C由两步反应A→B→C构成,1molA发生反应的能量曲线如图所示。下列有关叙述正确的是
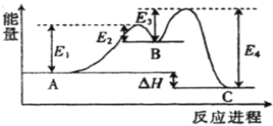
A. A
C的正反应为吸热反应
B. 加入催化剂会改变A与C的能量差
C. A
C正反应的活化能大于其逆反应的活化能
D. A
C的反应热△H=E1+E3-E2-E4
难度: 中等查看答案及解析
-
用CO 合成甲醇的化学方程式为CO(g)+2H2(g)
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
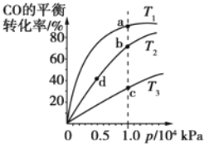
A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c),v(b)>v(d)
C. 平衡常数:K(a)>K(c)>K(b)>K(d)
D. 平均摩尔质量:M(a)>M(c),M(b)>M(d)
难度: 中等查看答案及解析
-
已知:2H2(g)+O2(g)
2H2O(g) △H1
3H2(g)+Fe2O3(s)
2Fe(s)+3H2O(g) △H2
2Fe(s)+3/2O2(g)
Fe2O3(s) △H3
2Al(s)+3/2O2(g)
Al2O3(s) △H4
2Al(s)+Fe2O3(s)
A12O3(s)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1<0,△H3>0 B. △H5<0,△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
难度: 中等查看答案及解析
-
一定温度下,向某恒容密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是

A. 反应在前10min内的平均反应速率v(D)=0.15mol·L-1·min-1
B. 该反应的平衡常数表达式为K=
C. 若平衡时保持温度不变,压缩容器容积,则平衡向逆反应方向移动
D. 反应至15min时,改变的条件是降低温度
难度: 中等查看答案及解析
-
已知,25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式
CH3COOH
HCN
H2C2O4
电离平衡常数
1.8×10-5
4.9×10-10
K1=5.9×10-2,K2=6.4×10-6
下列有关说法正确的是( )
A. CH3COOH溶液与Na2CO3反应生成CO2可以证明乙酸是弱酸
B. H2C2O4溶液的电离方程式为 H2C2O4
2H+ + C2O42-
C. 加水稀释HCN溶液,促进HCN的电离且c(CN-)/c(OH-)增大
D. 在Na2C2O4 溶液中加入足量的CH3COOH溶液发生反应的离子方程式为 C2O42- + CH3COOH=CH3COO- + HC2O4-
难度: 中等查看答案及解析
-
一定温度下,m g下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了n g,且n>m,符合此要求的物质是( )
①H2 ②HCHO ③CH4 ④HCOOCH3 ⑤CH3CHO
A. ①② B. ③⑤ C. ①②③④⑤ D. ④
难度: 中等查看答案及解析
-
在200 mL含Mg2+、Al3+、NH4+、H+、Cl―等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述不正确的是

A. x与y的差值为0.01 mol
B. 原溶液中c(Cl―)=0.75 mol·L-1
C. 原溶液的pH=1
D. 原溶液中n(Mg2+)∶n(Al3+)=5∶1
难度: 中等查看答案及解析
-
氨气是一种重要的化工原料,工业上用N2和H2合成NH3。现己知N2(g)和H2(g)反应生成1 molNH3(g)过程中能量变化示意图如下图。则N-H键键能为( )
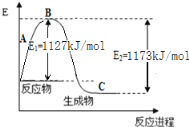
化学键
H-H
N≡N
键能(kJ/mol)
436
946
A. 248kJ/mol B. 391kJ/mol C. 862kJ/mol D. 431kJ/mol
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应 aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的物质的量变多 D. 再次平衡时的逆反应速率小于原平衡的正反应速率
难度: 中等查看答案及解析
-
某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)
A. 所得溶液中c(Cu2+)=0.225mol/L B. 所得溶液中c(H+)=0.03mol/L
C. 所得气体在标准状况下的体积为0.448L D. 反应中转移0.06mol的电子
难度: 中等查看答案及解析
-
在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
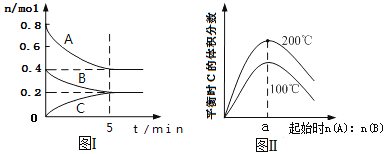
A. 图II所知反应xA(g)+yB(g)
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(L•min)
D. 当外界条件由200℃降温到100℃,平衡正向移动
难度: 中等查看答案及解析
-
CO和H2在一定条件下合成甲醇的反应为;CO(g)+2H2(g)
CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
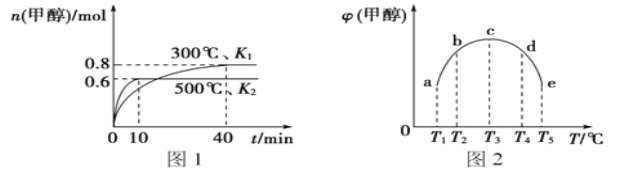
A. 该反应的△H1>0,且K1>K2
B. 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压
C. 300℃时,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移动
D. 500℃时,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2浓度和百分含量均增大
难度: 困难查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)△H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是( )
A. 甲和乙中反应的化学平衡常数相同 B. 乙和丙中的二氧化硫的生成速率相同
C. 乙中SO2的体积分数大于丙 D. 转化率:α甲(SO2)+α乙(SO3)<1
难度: 困难查看答案及解析
-
臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A
B
C
D
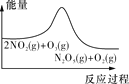



平衡后升温,NO2含量降低
0~2 s内,v(O3)=0.2 mol·L-1·s-1
v正:b点>a点
b点:v逆>v正
恒温,t1时再充入O3
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
难度: 困难查看答案及解析
-
某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
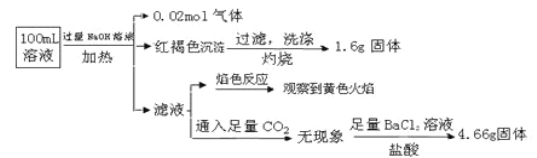
下列说法正确的是( )
A. 原溶液中c(Fe3+)=0.2 mol•L-1
B. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
C. SO42-、NH4+、Na+、CO32-一定存在,Cl-可能存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
难度: 中等查看答案及解析