-
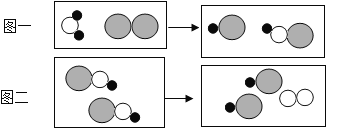
分析推理是化学学习中最常用的思维方法,下列说法正确的是
A. 元素是指具有相同质子数的一类原子的总称,具有相同质子数的粒子一定是同种元素
B. 单质是由同种元素组成的物质,由同种元素组成的物质不一定是单质
C. 碱溶液的pH大于7,pH大于7的溶液一定是碱溶液
D. 氧化物中一定含有氧元素,含氧元素的化合物一定是氧化物
难度: 中等查看答案及解析
-
下列离子在水中能大量共存,并形成无色溶液的是
A. Fe3+、Na+、NO3-、Cl- B. K+、Na+、Al3+、SO42-
C. H+、K+、SO42-、OH- D. Mg2+、NO3-、OH-、Cl-
难度: 困难查看答案及解析
-
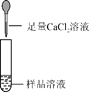
下列除去杂质的方法正确的是
选项
物质
杂质
除杂方法
A
CaCl2溶液
稀盐酸
加入过量的CaCO3,过滤
B
盐酸
硫酸
加入过量BaCl2溶液,过滤
C
NaNO3
NaCl
加入过量AgNO3溶液,过滤
D
CaO
Ca(OH)2
加过量水,过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列变化中属于物理变化的是( )
A. 铁矿石炼铁 B. 粮食酿酒 C. 二氧化碳制干冰 D. 纯碱制烧碱
难度: 简单查看答案及解析
-
规范的实验操作是实验成功的保证。下列实验操作错误的是( )
A.
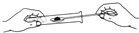 加入固体粉末 B.
加入固体粉末 B. 读取液体体积
C.
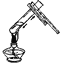 加热液体物质 D.
加热液体物质 D. 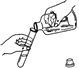 倾倒液体物质
倾倒液体物质难度: 简单查看答案及解析
-
染发时常用到的着色剂——对苯二胺,是一种有毒的化学药品,有致癌性,会对染发者的身体带来伤害,其化学式为C6H8N2。有关对苯二胺的说法正确的是 ( )
A. 对苯二胺属于化合物
B. 对苯二胺的相对分子质量为27
C. 对苯二胺中碳、氢、氮元素的质量比为3∶4∶1
D. 对苯二胺不能被人体吸收
难度: 中等查看答案及解析
-
下列处理方法不正确的是( )
A. 浓硫酸沾到皮肤上,立即用大量水冲洗 B. 图书馆着火,用二氧化碳灭火器灭火
C. 用点火法检查厨房内天然气是否泄漏 D. 进入久未开启的菜窖前,用燃着的蜡烛试验
难度: 中等查看答案及解析
-
下图是a、b、c三种物质的溶解度曲线图,现有一定温度下的a、b、c的不饱和溶液,分别通过增加溶质、蒸发溶剂或升高温度三种方法,均可变成饱和溶液的是
A.a溶液 B.b溶液
C.c溶液 D.a溶液和c溶液
难度: 困难查看答案及解析
-
金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组在实验室探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度足量稀盐酸中,观察现象如下:
金属
Ti
Mg
Cu
金属表面现象
放出气泡速度缓慢
放出气泡速度快
无变化
下列有关三种金属的说法正确的是:( )
A. 三种金属的活泼性由强到弱的顺序是:Ti、Mg、Cu
B. 若Ti粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C. 用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D. 温度、金属表面积、盐酸浓度等因素都会影响反应速率
难度: 简单查看答案及解析
-
下列图象能正确反映对应变化关系的是( )
A. 两份等质量的氯酸钾在有、无MnO2的情况下加热产生氧气
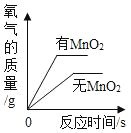
B. 加水稀释浓盐酸
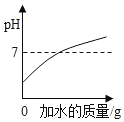
C. 向稀盐酸和氯化钙的混合溶液中加入碳酸钠溶液
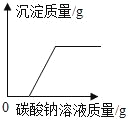
D. 将足量粉末状的铁和镁分别与等质量,等质量分数的稀盐酸反应
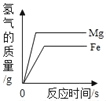
难度: 简单查看答案及解析