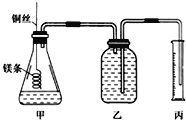
-
设NA为阿伏加德罗常数的值,下列说法正确的有( )个
①常温常压下,28gC2H4和C4H8的混合物中一定含有6NA个原子
②0℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有2NA个电子转移
③常温下,pH=12的氢氧化钠溶液中OH-数目为0.01NA
④1L1.0mol/LFeCl3溶液全部水解制备氢氧化铁胶体,所得氢氧化铁胶粒数目为NA
⑤T℃时,1LpH=6纯水中,含10-6NA个H+
⑥常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
⑦lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
⑧100克质量分数为46%的乙醇溶液中,含有的氧原子数目为NA
⑨标准状况下,22.4LHF气体中含有NA个气体分子
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
-
中国《诗词大会》不仅弘扬了中国传统文化,还蕴含了许多化学知识,下列诗词与蒸馏原理有关的是( )
A. 日照香炉生紫烟,遥看瀑布挂前川 B. 千淘万漉虽辛苦,吹尽狂沙始到金
C. 折戟沉沙铁未销,自将磨洗认前朝 D. 千锤万凿出深山,烈火焚烧若等闲
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法正确的是( )
A. 维生素C对人体有益且人体不能合成,长期、大量服用有利于健康
B. 高锰酸钾溶液、酒精、双氧水能杀菌消毒是利用了它们的强氧化性
C. 小苏打做糕点的膨松剂是由于NaHCO3能与碱反应
D. “火树银花”中火焰实际上是金属元素的焰色反应
难度: 简单查看答案及解析
-
分类是化学研究的重要方法,下列物质分类错误的是( )
A. 化合物:干冰、明矾、烧碱
B. 同素异形体:石墨、C60、金刚石
C. 非电解质:乙醇、四氯化碳、氯气
D. 混合物:漂白粉、纯净矿泉水、盐酸
难度: 简单查看答案及解析
-
下列有关化学用语的描述不正确的是( )
A. MgF2的电子式:

B. 中子数为15的硅原子:
C. 次氯酸的结构式:H—Cl—O
D. NH3·H2O的电离方程式:NH3·H2O
NH4++OH—
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42—、Cl-
B. Kw/c(OH-)=1×10-1mo1·L-1的溶液中:NH4+、Fe3+、Cl-、SO42—
C. 与A1反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42—
D. 水电离的c(H+)=1×10-13mo1·L-1的溶液中:K+、Na+、AlO2—、SiO32—
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. CCl4、C2H4、SiO2都存在共价键,它们都是共价化合物
B. SO2溶于水时,需克服共价键和分子间作用力
C. CO2和N2中,每个原子的最外层都具有8电子稳定结构
D. 某物质在熔融状态能导电,则该物质中一定含有离子键
难度: 中等查看答案及解析
-
现有Na2SO3、Na2SO4混合物样品a g,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是( )
A. 将样品配制成V1 L溶液,取其中25.00 mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液的体积是V2 ml
B. 将样品与足量稀盐酸充分反应,生成的气体通过盛有碱石灰的干燥管,测得干燥管增重cg
C. 向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为b g
D. 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为d g
难度: 困难查看答案及解析
-
下列各组离子能大量共存,当加入相应试剂后,发生反应的离子方程式正确的是( )
选项
离子组
加入试剂
发生的离子反应方程式
A
NH4+、Fe2+、SO42-
少量Ba(OH)2溶液
2NH4++SO42-+2OH-+Ba2+=BaSO4↓+2NH3·H2O
B
Fe2+、NO3-、HSO3-
NaHSO4溶液
HSO3-+H+=SO2↑+H2O
C
K+、OH-、CO32-
通入过量CO2
2OH-+CO2=CO32-+H2O
D
Na+、OH-、Cl-
少量Mg(HCO3)2溶液
Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是( )
A. Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间
B. 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应
C. 三种分散系中分散质均属于电解质
D. Fe(OH)3胶体、Fe(OH)3浊液均能与盐酸反应,且反应现象相同
难度: 中等查看答案及解析
-
下列实验方案设计正确的是( )
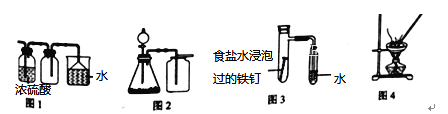
A. 利用图1收集干燥的氯化氢气体
B. 选择合适的试剂,利用图2可分别制取并收集少量CO2、NO和O2
C. 利用图3可验证铁发生吸氧腐蚀
D. 利用图4蒸干NH4Cl饱和溶液制备NH4Cl晶体
难度: 中等查看答案及解析
-
向一定量的Cu、CuO、Fe2O3的混合物中加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
A. 0.8g B. 1.6g C. 2.4g D. 3.2g
难度: 困难查看答案及解析
-
已知某透明澄清的溶液中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀;②将沉淀过滤、洗涤、灼烧,得到1.6 g固体;③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是( )
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl-、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2mol·L-1,c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
难度: 中等查看答案及解析
-
a mol FeS与b mol FeO投入到VL cmol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
① (3a+3b)mol ②[Vc-(9a+b)/3]mol ③ Vc-(a+b)/3 mol ④(a+b)×189g
A. ①②④ B. ①② C. ②④ D. ②③④
难度: 困难查看答案及解析
-
将物质的量均为a mol的FeCl3和CuCl2投人水中形成混合溶液,再加入bmol铁粉充分反应(忽略离子的水解),下列说法中不正确的是( )
A. 当a/2<b<3a/2时,反应后的溶液中n(Cu2+):n(Fe2+)= (3a/2-b):(b+a)
B. 当b≥3a/2时,发生总反应的离子方程式为2Fe3++Cu2++2Fe=4Fe2++Cu
C. 当b≤a/2时,发生的离子反应为2Fe3++Fe=3Fe2+
D. 当a/2<b<3a/2时,反应中转移电子的物质的量:a mol<n(e-)<3a mol
难度: 困难查看答案及解析
-
向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸, CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )
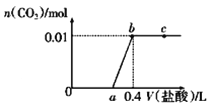
A. a点时溶液中存在c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. 0-a段溶液中水电离出的OH—浓度先增大后减小
C. a=0.2
D. ab段发生反应的离子方程式为CO32-+2H+=H2O+CO2↑
难度: 困难查看答案及解析