-
化学与人类生活、生产密切相关,下列说法正确的是
A. 在厨房里可用米汤检验加碘食盐中的碘
B. 为测定熔融氢氧化钠的导电性,常将氢氧化钠固体放在石英坩埚中加热熔化
C. 14C可用于文物年代的鉴定,14C与12C互为同位素
D. 铁元素在人体中主要以Fe2+的形式存在,是血红细胞的组成之一。喝补铁剂时,加服维生素C效果更好,原因是维生素C具有氧化性
难度: 简单查看答案及解析
-
下列有关说法错误的是
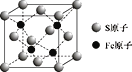
A. NaCl晶胞中Na+的配位数为6且构成正八面体
B. 由石墨比金刚石稳定可知:C(金刚石,s) ===C(石墨,s) ΔH>0
C. 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol。假设熔化热完全用于打破冰的氢键,最多能破坏冰中15%的氢键,则每摩尔冰中平均有2 mol氢键
D. 石墨中的碳原子采用sp2杂化构成平面层状结构,12g石墨中碳碳键数为1.5NA
难度: 困难查看答案及解析
-
X溶液中含有下表离子中的某5种,且其浓度均为 0. 1mol/L(不考虑水的电离与离子水解)。向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后 阴离子种类没有变化。下列叙述不正确的是
阳离子
阴离子
Na+ 、Mg2+、Al3+、Ca2+
Fe2+ 、Fe3+
OH−、CO32−、HCO3−
Cl−、NO3−、SO42−
A. 生成无色气体的离子方程式为:3Fe2+ +NO3−+4H+===3Fe3++NO ↑+2H2O
B. X溶液中不可能含有HCO3−或CO32−
C. 根据电荷守恒,原溶液中一定含Mg2+
D. X溶液中含有3种阳离子、2种阴离子
难度: 困难查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期元素。X、W同主族,Z、W同周期,X原子核内质子数是Y原子核内质子数的3/4,W原子最外层电子数是Z原子最外层电子数的4倍。下列说法中正确的是
A. 原子半径:r(X)>r(Y)>r(W)>r(Z)
B. X、Y、Z三种元素形成的化合物中存在离子键和共价键
C. 元素W的气态氢化物的热稳定性比元素X的强
D. Y和W形成的化合物的熔点比Y和Z形成的化合物的熔点低
难度: 简单查看答案及解析
-
下列实验,对应的现象及结论都正确且两者具有因果关系的是
选项
实 验
现 象
结 论
A
将纯碱与足量浓盐酸反应后产生的气体直接通入硅酸钠溶液中
溶液变浑浊
非金属性:Cl>C>Si
B
向某溶液中先加入几滴Ba(NO3)2,再加入足量的硝酸酸化
先产生白色淀后无明显变化
原溶液中一定含有SO42−
C
在盛有红褐色Fe(OH)3胶体的U形管的两个管口,各插入一个电极,并使两极与直流电源相连
阴极附近溶液颜色逐渐加深
Fe(OH)3胶体带有正电荷
D
向某酸溶液中加入一小段废光纤
一段时间后
废光纤溶解
原酸溶液中一定含有氢氟酸
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于物质结构的命题中,错误的项数有
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于P区
③非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2这样的分子
④冰中存在极性共价键和氢键两种化学键的作用
⑤Cu(OH)2是一种蓝色絮状沉淀,既溶于硝酸、氨水,也能溶于硫酸氢钠溶液中
⑥熔融态的HgCl2不导电,HgCl2稀溶液有弱的导电能力说明固态HgCl2是分子晶体,为非电解质
⑦氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3.H2O分子,根据氨水的性质可知NH3.H2O的结构式可记为:
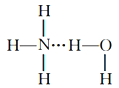
A. 4项 B. 5项 C. 6项 D. 7项
难度: 困难查看答案及解析
-
PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将一定量的PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2。反应中生成的O2和Cl2 的物质的量之比为3:2,分解释放O2后固体的组成及物质的量比是
A. 1:1混合的Pb3O4, PbO B. 1:2混合的PbO2, Pb3O4
C. 2:1:4混合的PbO2, Pb3O4, PbO D. 1:2:4混合的PbO2, Pb3O4, PbO
难度: 困难查看答案及解析