-
利用海水制取淡水的传统方法是
A. 蒸发 B. 过滤 C. 分液 D. 蒸馏
难度: 简单查看答案及解析
-
下列有关环境保护与绿色化学的叙述不正确的是( )
A. 形成酸雨的主要物质是硫的氧化物和氮的氧化物
B. 大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C. 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D. 水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的
难度: 简单查看答案及解析
-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③⑤⑥⑦⑧ D. ③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
在298K、100kPa时,已知: ①2H2O(g)=O2(g)+2H2(g) ΔH1
② Cl2(g)+H2(g)=2HCl(g) ΔH2③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A. Δ H3=ΔH1+2ΔH2 B. Δ H3=ΔH1+ΔH2
C. Δ H3=ΔH1-2ΔH2 D. Δ H3=ΔH1-ΔH2
难度: 中等查看答案及解析
-
已知化学反应2C(s)+O2(g)
2CO(g),2CO(g)+O2(g)
2CO2(g)都是放热反应,据此判断,下列说法中不正确的是(其他条件相同)( )
A. 12 g碳所具有的能量一定高于28 g CO所具有的能量
B. 56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量
C. 12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D. 将一定质量的C燃烧,生成CO2比生成CO时放出的热量多
难度: 中等查看答案及解析
-
下列反应的能量变化与其它三个不相同的是
A. 铝粉与氧化铁的反应
B. 氯化铵与消石灰的反应
C. 锌片与稀硫酸反应
D. 钠与冷水反应
难度: 简单查看答案及解析
-
下列热化学方程式中△H的含义表示正确的是
A. H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H(中和热)
B. NaOH(aq)+
H2SO4(浓)=
Na2SO4(aq)+H2O(l) △H(中和热)
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H(燃烧热)
D. 2H2(g)+O2(g)=2H2O(g) △H(燃烧热)
难度: 简单查看答案及解析
-
下列说法正确的是
A. 焓变单位中kJ·mol-1,是指1 mol物质参加反应时的能量变化
B. 当反应放热时△H﹥0,反应吸热时△H﹤0
C. 一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,△H为“+”
D. 一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,△H为“-”
难度: 中等查看答案及解析
-
已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
化学物质
H2(g)
Br2(g)
HBr(g)
1mol分子中的化学键断裂时需要吸收的能量/KJ
436
a
369
则表中a为( )
A.404 B.260 C.230 D.200
难度: 中等查看答案及解析
-
已知H2(g)+Cl2(g)=2HCl(g) △H= ―184.6kJ·mol-1, 则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为
A. +184.6kJ·mol-1 B. -92.3 kJ·mol-1
C. -184.6 kJ·mol-1 D. +92.3 kJ·mol-1
难度: 简单查看答案及解析
-
甲烷是一种高效清洁的能源,0.25 mol甲烷完全燃烧生成液态水时放出222.5 kJ热量,则下列热化学方程式正确的是
A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) △H=+890 kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890 kJ·mol-1
C. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) △H=-890 kJ·mol-1
D. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
难度: 简单查看答案及解析
-
同温同压下,已知下列反应均为放热反应,下列各热化学方程式中△H最小的是
A. 2A(l)+B(l) =2C(g) △H1 B. 2A(g)+B(g) =2C(g) △H2
C. 2A(g)+B(g) =2C(l) △H3 D. 2A(l)+B(l) =2C(l) △H4
难度: 中等查看答案及解析
-
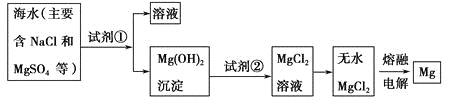
下列关于金属冶炼的说法正确的是
A. 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al
B. 可以用钠加入氯化镁饱和溶液中制取镁
C. 炼铁高炉中所发生的反应都是放热的,故无需加热
D. 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定
难度: 中等查看答案及解析
-
从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,不正确的是
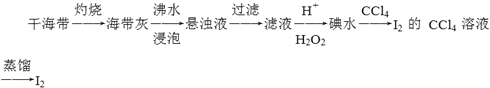
A. 实验室在蒸发皿中灼烧干海带,并且用玻璃搅拌
B. 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C. 在碘水中加入几滴淀粉溶液,溶液变蓝色
D. 碘水中加入CCl4得到I2的CCl4的溶液,该操作为“萃取”
难度: 简单查看答案及解析
-
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 kJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 kJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3kJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少kJ
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2
C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
难度: 中等查看答案及解析
-
下列说法或表示法正确的是
A. 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由C(石墨)→C(金刚石) ΔH = +119 kJ·mol-1可知,石墨比金刚石稳定
C. 在稀溶液中:H++OH-=H2O ΔH = -57.3 kJ· mol-1,若将含1mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,热化学方程式表示为:2H2(g)+ O2(g)=2H2O(l) ΔH = +285.8 kJ· mol-1
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
① C(s) + O2(g) = CO2(g) ;ΔH1 C(s) +
O2(g) = CO(g) ;ΔH2
② S(s) + O2(g) =SO2(g) ;ΔH3 S(g) + O2(g) = SO2(g) ;ΔH4
③ H2(g) +
O2(g) =H2O(l) ;ΔH5 2H2(g) + O2(g) = 2H2O(l) ;ΔH6
④ CaCO3(s) = CaO(s) + CO2(g) ;ΔH7 CaO(s) + H2O(l) = Ca(OH)2(s) ;ΔH8
A. ① B. ④ C. ②③④ D. ①②③
难度: 中等查看答案及解析
-
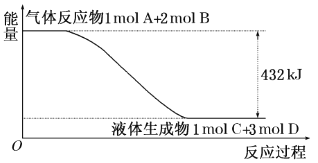
根据反应Br+H2
HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是( )
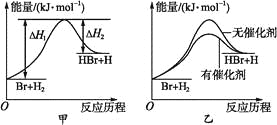
A. 正反应吸热
B. 加入催化剂,该化学反应的反应热不变
C. 加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示
D. 加入催化剂可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析