-
下列说法不正确的是
①将BaSO4放入水中不能导电,所以BaSO4是非电解质 ②氨溶于水得到的氨水能导电,所以氨水是电解质 ③固态共价化合物不导电,熔融态的共价化合物可以导电 ④固态的离子化合物不导电,熔融态的离子化合物也不导电 ⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A. ①④ B. ①④⑤ C. ①②③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
化学与能源开发、环境保护、资源利用等密切相关
下列说法正确的是
A. 天然气、石油、流水、风力、氢气为一级能源
B. 无论是风力发电还是火力发电,都是将化学能转化为电能
C. PM
含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
D. 发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统
难度: 简单查看答案及解析
-
下列说法或表示方法正确的是
A. 等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多
B. 由C(石墨)= C(金刚石) △H=+1.90 kJ/mol可知,金刚石比石墨稳定
C. 在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ/mol
D. 在稀溶液中,H+(aq)+ OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ
难度: 中等查看答案及解析
-
用CH4催化还原NOX可以消除氮氧化物的污染,例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH2=﹣1 160 kJ•mol﹣1。
已知NO、NO2混合气体的密度是相同条件下氢气密度的17倍,16 g甲烷和该混合气完全反应生成N2、CO2、H2O(g)放出1 042.8 kJ的热量,则ΔH1是( )
A. ﹣867 kJ•mol﹣1 B. ﹣574 kJ•mol﹣1 C. ﹣691.2 kJ•mol﹣1 D. ﹣925.6 kJ•mol﹣1
难度: 困难查看答案及解析
-
下列各组物质反应中,溶液的导电能力比反应前明显增强的是 ( )
A. 向氢碘酸溶液中加入液态溴 B. 向硝酸银溶液中通入少量氯化氢
C. 向氢氧化钠溶液中通入少量氯气 D. 向硫化氢饱和溶液中通入少量氯气
难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示转化关系,且ΔH=ΔH1+ΔH2,则X、Y可能是
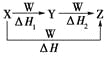
①C、CO ②S、SO2③AlCl3、Al(OH)3④Na2CO3、NaHCO3⑤Fe、FeCl2
A. ①②③④⑤ B. ②④⑤
C. ①③④ D. ①②③
难度: 中等查看答案及解析
-
常温下,分别将四块形状基本相同,质量均为9 g的铁块同时投入到下列四种溶液中,产生氢气速率最快的是( )
A. 200 mL 2 mol·L-1盐酸 B. 50 mL 2 mol·L-1H2SO4溶液
C. 100 mL 3 mol·L-1盐酸 D. 500 mL 6 mol·L-1HNO3溶液
难度: 中等查看答案及解析
-
加热N2O5时,发生以下两个分解反应:N2O5
N2O3+O2,N2O3
N2O+O2,在1 L密闭容器中加入4 mol N2O5达到化学平衡时c(O2)为4.50 mol/L,c(N2O3)为1.62 mol/L,则在该温度下各物质的平衡浓度正确的是( )
A. c(N2O5)=1.44 mol/L B. c(N2O5)=0.94 mol/L
C. c(N2O)=1.40 mol/L D. c(N2O)=3.48 mol/L
难度: 中等查看答案及解析
-
一定温度下有可逆反应:A(g)+2B(g)
2C(g)+D(g)。现将4 mol A(g)和8 mol B(g)加入到体积为2 L的某密闭容器中,反应至4 min时改变某一条件,测得C的物质的量浓度随时间变化的曲线如图所示。下列有关说法中正确的是( )
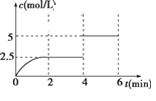
A. 0~2 min内,正反应速率逐渐增大
B. 4 min时,A的转化率为50%
C. 6 min时,B的体积分数为25%
D. 4 min时,改变条件后,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
已知:2SO2(g)+O2(g)
2SO3(g) △H=Q(Q<0),向同温、同体积的三个真空密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2 和0.5molO2;(丙)2molSO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p:p甲=p丙<2p乙
B. SO3的质量m:m甲=m丙<2m乙
C. c(SO2)与c(O2)之比k:k甲=k丙>2k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
难度: 困难查看答案及解析
-
已知H2(g)+I2(g)
2HI(g),现有相同容积体积可变的两个绝热容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在起始温度相同的条件下分别达到平衡。下列说法正确的是( )
A. 平衡时甲、乙两容器的体积相等 B. 平衡时甲、乙两容器中c(H2)相等
C. 平衡时甲、乙两容器中v(H2)相等 D. 平衡时甲、乙两容器中气体总物质的量相等
难度: 困难查看答案及解析
-
某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B
2C。若维持温度和压强不变,当达到平衡时容器的体积为V L,其中C气体的体积占10%。下列推断正确的是( )
①原混合气体的体积为1.2V L ②原混合气体的体积为1.1V L ③反应达到平衡时气体A消耗掉0.05V L④反应达到平衡时气体B消耗掉0.05V L
A. ②③ B. ②④ C. ①③ D. ①④
难度: 中等查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应
达到平衡,正反应速率随时间变化的示意图如下所示。
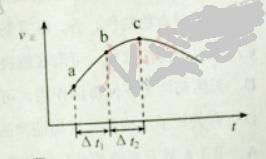
A. 反应在c 点达到平衡状态
B. 反应物浓度:
点小于
点
C. 反应物的总能量低于生成物的总能量
D.
时,SO2的转化率:
段小于
段
难度: 中等查看答案及解析
-
x、y、z为三种气体,把a mol x和b mol y充入一密闭容器中,发生反应,x+2y
2z达到平衡时,若它们的物质的量满足n(x)+n(y)=n(z),则y的转化率为
A. (a+b)/5×100% B. 2(a+b)/5b×100%
C. 2(a+b)/5×100% D. (a+b)/5a×100%
难度: 中等查看答案及解析
-
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是( )
A. 16.7% B. 20.0% C. 80.0% D. 83.3%
难度: 中等查看答案及解析
-
1molX气体跟a molY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)
bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是( )
A. a=1,b=3 B. a=2,b=1 C. a=2,b=2 D. a=3,b=2
难度: 中等查看答案及解析