-
在一定温度下,醋酸溶液中存在电离平衡:CH3COOH CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+) 与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(2)已知:25 ℃时,该电离平衡的平衡常数为1.75×10-5。
①求该温度时,a mol·L-1的醋酸溶液中c1(H+)=________________mol·L-1 (用含a的代数式表示)。[提示:此时电离度比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为b mol·L-1,则此时c2(H+)=____________________mol·L-1(用含a、b的代数式表示)。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
-
在一定温度下,醋酸溶液中存在电离平衡CH3COOH CH3COO-+H+
CH3COO-+H+
(1)某温度时,0.1mol·L-1的醋酸溶液中的c(H+)与0.01mol·L-1的醋酸溶液中的c(H+)的比值___(填“大于”“小于”或“等于”)10;
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是:___;
A.c(H+) B. C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.
(3)现有pH均为3的醋酸、硫酸两瓶溶液:
①设两种溶液的物质的量浓度依次为c1、c2,则其关系式为:c1___c2(用“<”“>”或“=”表示,下同);
②取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入少量等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式为v1___v2;反应结束放出的氢气的体积依次为V1、V2,则其关系式为V1___V2。
-
在一定温度下,醋酸溶液中存在电离平衡:CH3COOH  CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+) 与0.01 mol·L-1 的醋酸溶液中的c(H+)的比值 ____(填“大于”“小于”或“等于”)10,理由是_________。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是:_____________。
A.c(H+) B. C.c(H+)·c(OH−) D.c(OH−)/c(H+)
C.c(H+)·c(OH−) D.c(OH−)/c(H+)
(3)现有pH均为3的醋酸、硫酸两瓶溶液:
①设两种溶液的物质的量浓度依次为c1、c2,则其关系式为_________(用“<”“>”或“=”表示,下同)。
②取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入少量等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式为_______,反应结束放出的氢气的体积依次为V1、V2,则其关系式为_____。
-
(10分)在一定温度下,醋酸溶液存在电离平衡:
CH3COOH  CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值 _________________(填“大于”、“小于”或“等于”)10
(2)已知:25℃时,该电离平衡的平衡常数为1.75×10-5
①求该温度时,amol/L的醋酸溶液中c1(H+)=________________mol/L (用含a的代数式表示)。
-
(12分)已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO‾+H+ ΔH>0。
CH3COO‾+H+ ΔH>0。
(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO‾)=_________;下列方法中,可以使0.10 mol·L‾1CH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol·L‾1的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol·L‾1
e.加入少量氯化钠固体
f.加入少量0.10 mol·L‾1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:υ(盐酸)_________υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va____Vb。
(4)已知:90℃时,水的离子积常数为Kw = 38×10‾14,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=__________(保留三位有效数字)。
-
(14分)已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO‾+H+ ΔH>0。
CH3COO‾+H+ ΔH>0。
(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO‾)=__________;下列方法中,可以使0.10 mol·L‾1CH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol·L‾1的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol·L‾1
e.加入少量氯化钠固体
f.加入少量0.10 mol·L‾1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)______V(醋酸),反应的最初速率为:υ(盐酸)_____υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va____Vb;溶液中各离子的浓度按照由大到小排序为___________。
(4)已知:90℃时,水的离子积常数为Kw = 38×10‾14,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)。
-
(1)0.1 mol/L醋酸溶液中,存在电离平衡CH3COOH H++CH3COO-。经测定溶液中c(CH3COO―)为1.4×10-3 mol/L,此温度下醋酸的电离平衡常数Ka=________。
H++CH3COO-。经测定溶液中c(CH3COO―)为1.4×10-3 mol/L,此温度下醋酸的电离平衡常数Ka=________。
(2)已知饱和硫化氢的浓度为0.1 mol/L,硫化氢的电离常数为Ka1=1.0×10-7,Ka2=1.0×10-19,计算饱和硫化氢溶液中氢离子的浓度为__________mol/L。
-
弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问題。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;水的电离程度将________(填“增大”、“减小”或“不变”)。
(2)99℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为__________。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是________(填字母)。
a. 、
、 b.
b. 、
、 c.
c. 、
、 d.H2SO3、
d.H2SO3、
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是_______。
(4)0.1 mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中 c(H2A)________c(A2-)(填“>”、“<”或“=”),作出此判断的依据是__________(用文字解释)。
-
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
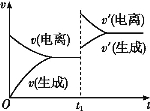
A.加少量烧碱溶液 B.升高温度 C.加少量冰醋酸 D.加水
-
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中 值增大,可以采取的措施是
值增大,可以采取的措施是
A.加少量烧碱溶液 B.降低温度
C.加少量冰醋酸 D.加水
CH3COO- + H+
