-
设NA为阿伏加德罗常数的值。下列说法正确的是 ( )
A. 1.8 g H2O与CH2D2的混合物中所含的质子数为NA
B. 1 mol甲烷或白磷(P4)分子中所含的共价键数均为4NA
C. 1 mol CH3COOC2H5在稀硫酸中水解可得到的乙醇分子数为NA
D. 25 ℃时,1 L pH=1的H2SO4溶液中含有的H+数为0.2NA
难度: 中等查看答案及解析
-
化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是( )
A. K2FeO4是新型净水剂,其净水原理与明矾完全相同
B. 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质
C. 棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品
D. 为延长瓜果或花朵的成熟期,可用浸泡过高锰酸钾溶液的硅藻土吸收其释放的气体
难度: 简单查看答案及解析
-
下列关于有机化合物说法正确的是( )
A. 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯
B.
 是由单体CH2=CH—CH3和CH2=CH2发生加聚反应的产物
是由单体CH2=CH—CH3和CH2=CH2发生加聚反应的产物C. 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程
D. 淀粉与纤维素互为同分异构体,二者水解的最终产物相同
难度: 简单查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
将稀硫酸和碳酸钠反应生成的气体通入一定浓度的硅酸钠溶液中
出现白色胶状沉淀
酸性:H2SO4 >H2CO3> H2SiO3
B
向某溶液中滴加氯水后再加入KSCN溶液
溶液变为红色
溶液中一定含有Fe2+
C
加热盛有氯化铵固体的试管
试管底部固体消失,试管口有晶体凝结
氯化铵固体可以升华
D
向硫酸铜溶液中通入氯化氢气体
溶液的蓝色褪去,生成黑色沉淀
氢硫酸 的酸性比硫酸强
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成。其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子。下列说法错误的是( )
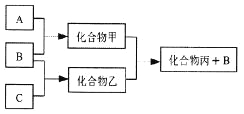
A. Z元素位于第二周期第VIA族
B. 可用排水法收集化合物乙
C. 元素X、Y、Z的原子半径大小关系为X<Z<Y
D. 化合物甲溶于化合物丙中,存在的微粒有5种
难度: 中等查看答案及解析
-
将打磨后的镁条放入盛有50ml蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图。下列有关描述正确的
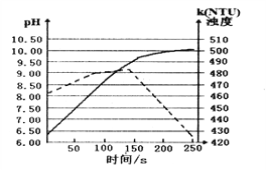
A. 该实验是在常温下进行的
B. 实线表示溶液浊度随时间的变化
C. 50s时向溶液中滴入酚酞试液,溶液变红
D. 150s后溶液浊度下降是因为生成的Mg(OH)2沉降
难度: 困难查看答案及解析
-
下列关于电解质溶液的叙述正确的是( )
A. 若常温下0.1mol/L的氨水pH为11, 则NH3·H2O电离常数约为10-6
B. 将pH=5的醋酸溶液稀释1000倍,溶液的pH=8
C. 某温度下纯水中c(OH-)=2×10—7mol/L,该温度下0.1mol/L的盐酸的pH=1
D. 用等浓度的NaOH溶液中和等体积pH=2与pH=3的醋酸,所消耗的NaOH溶液的体积前者小于后者的10倍
难度: 中等查看答案及解析

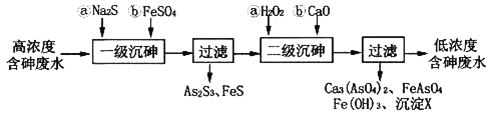

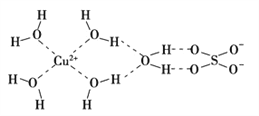
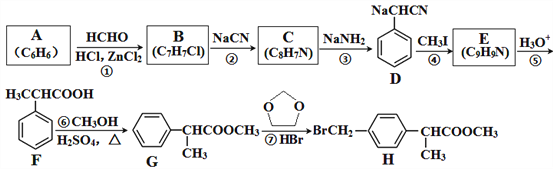
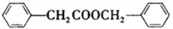 的合成路线_________________________________________________________________________。
的合成路线_________________________________________________________________________。