-
下列生活用品中,用合成材料制成的是
A. 不锈钢盆 B. 陶瓷碗 C. 纯棉袜子 D. 塑料饭盒
难度: 简单查看答案及解析
-
“幽庭脉脉橘花香”主要体现了分子
A. 间隔变大 B. 种类改变 C. 不停地运动 D. 大小改变
难度: 简单查看答案及解析
-
下列表示2个亚铁离子的是
A. 2Fe2+ B. 2Fe3+ C. 2Fe+2 D. 2Fe
难度: 简单查看答案及解析
-
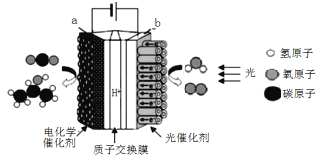
今年是国际化学元素周期表年。如图是氟原子结构示意图和氟元素在周期表中的部分信息,下列说法正确的是
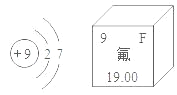
A. 属于金属元素
B. 氟原子的核外电子数是9
C. 相对原子质量是19.00g
D. 氟原子在化学反应中易失电子
难度: 简单查看答案及解析
-
燃放烟花爆竹是我国的传统习俗,如图是2019年春节期间我市某地PM2.5含量随时间变化趋势图,下列说法正确的是
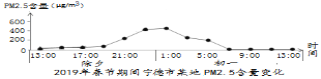
A. 由图可知,初一7:00~13:00时间段里燃放烟花爆竹最多
B. 春节期间我们可以任意燃放烟花爆竹
C. 燃放烟花爆竹后会闻到刺激性的气味,是因为产生了二氧化碳
D. 大量集中燃放烟花爆竹会增大空气中PM2.5含量
难度: 简单查看答案及解析
-
下列实验操作正确的是
A. 倾倒液体
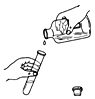 B. 滴加液体
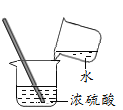
B. 滴加液体C. 稀释浓硫酸
 D. 收集二氧化碳
D. 收集二氧化碳难度: 简单查看答案及解析
-
除去下列物质中所含的杂质,所选除杂试剂或方法正确的是
序号
物质
所含杂质
除杂试剂或方法
A
Cu
CuO
通入氧气并加热
B
CaO
CaCO3
稀盐酸
C
CO
CO2
通过氢氧化钠溶液
D
MnO2
KMnO4
充分加热
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
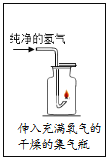
蜡烛点燃后用氧气传感器测定瓶中氧气的含量,数据如图,下列说法正确的是
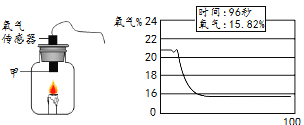
A. 该实验是在纯氧条件下进行
B. 氧气浓度过低不支持蜡烛燃烧
C. 蜡烛燃烧后瓶内剩余气体都是二氧化碳
D. 图中瓶壁上有水珠生成,说明蜡烛燃烧只发生化学反应
难度: 中等查看答案及解析
-
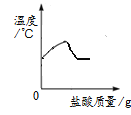
向大理石和稀盐酸制备CO2后的残留液中滴加Na2CO3溶液,测得溶液pH变化曲线如图(已知CaCl2溶液呈中性)。下列说法错误的是
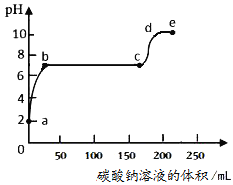
A. a点表示残留液中含有盐酸
B. ab段表示CaCO3沉淀的质量逐渐增加
C. bc段表示残留液中的CaCl2与滴入Na2CO3溶液反应
D. cd和de段溶液中含有的溶质是NaCl和Na2CO3
难度: 困难查看答案及解析
 B.
B. 
 D.
D.