-
下列属于电解质的是
A、硫酸溶液 B、铜 C、NaCl D、CO2
难度: 简单查看答案及解析
-
下列物质对应的用途错误的是( )
A. 镁合金:制造火箭、飞机 B. 纯碱:焙制糕点的发酵粉
C. 氧化镁:耐高温材料 D. 过氧化钠:漂白剂和供氧剂
难度: 中等查看答案及解析
-
中国最新战机歼-31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应如下:TiCl4+2Mg
Ti+2MgCl2。下列有关该反应的说法正确的是

A. TiCl4是还原剂 B. Mg被氧化
C. TiCl4发生氧化反应 D. Mg得到电子
难度: 简单查看答案及解析
-
A. 钠保存在煤油中 B. 氯水保存棕色细口瓶中
C. 液氯可以保存在干燥的钢瓶中 D. 溴化银保存在无色试剂瓶中
难度: 中等查看答案及解析
-
下列化学用语中,不正确的是( )
A. Cl﹣的结构示意图:
B. 质子数为6,中子数为8的原子为:14C
C. 12C、14C互为同位素 D. 一个氢氧根离子含有9个电子
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 用硝酸酸化的AgNO3 溶液可鉴别NaCl、 NaBr、 KI 三种溶液
B. 可用饱和NaCl溶液除去Cl2中的HCl 气体
C. 用加热方法可除去Na2CO3固体中的NaHCO3
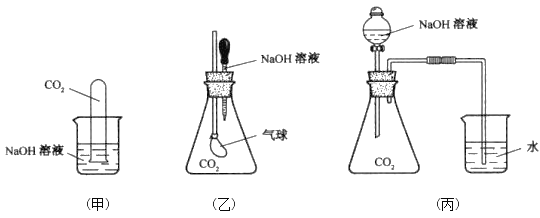
D. 可用饱和Na2CO3溶液除去CO2中的HCl 气体
难度: 中等查看答案及解析
-
下列说法中正确的是(NA表示阿伏加德罗常数的值) ( )
A. 在常温常压下,11.2 L N2含有的分子数为0.5NA
B. 2.3g金属钠和氧气反应生成氧化钠和过氧化钠的混合物,反应转移的电子数为0.1NA
C. 在标准状况下,18 g H2O的体积约为22.4 L
D. 0.1mol/L NaCl溶液中所含的Na+数为0.1 NA
难度: 中等查看答案及解析
-
海带中含碘元素。从海带中提取碘有如下步骤:①在滤液中通入足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤。合理的操作顺序是( )
A. ①②③④⑤ B. ②⑤①③④ C. ①③⑤②④ D. ②①③⑤④
难度: 中等查看答案及解析
-
下列有关钠和镁的说法中,不正确的是( )
A. 电解熔融NaCl可以得到金属钠
B. 金属钠在高温下能将TiCl4中的钛置换出来
C. 电解MgCl2溶液可以得到金属镁
D. 金属镁燃烧后会发出耀眼的白光,因此常用来制造信号弹和焰火
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. MnO2与浓盐酸混合加热:MnO2+4H++2Cl﹣
Mn2++Cl2↑+2H2O
B. 大理石与盐酸反应:CO32﹣+2H+ = H2O+CO2↑
C. 向醋酸溶液中滴加NaOH溶液:OH-+H+
H2O
D. 漂白粉溶液吸收二氧化碳:Ca2++ CO2+ H2O = CaCO3↓+2H+
难度: 中等查看答案及解析
-
在碱性溶液中能大量共存的离子组是( )
A. K+、Mg2+、MnO4﹣、Cl﹣ B. Na+、Ba2+、NO3﹣、Cl﹣
C. Na+、H+、SO42﹣、Cl﹣ D. Ca2+、K+、CO32﹣、NO3﹣
难度: 中等查看答案及解析
-
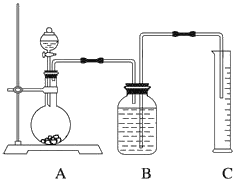
如下图所示装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )
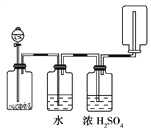
A. 锌和盐酸生成氢气
B. 二氧化锰和浓盐酸生成氯气
C. 碳酸钙和盐酸生成二氧化碳
D. 过氧化氢和MnO2生成氧气
难度: 中等查看答案及解析
-
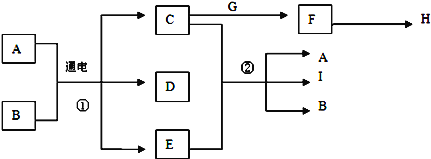
某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下,下列说法中,错误的是( )

A. 操作①发生的反应为非氧化还原反应
B. 若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
C. 操作②是蒸发浓缩结晶
D. 在整个制备过程中,未发生置换反应
难度: 困难查看答案及解析
-
同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是( )
A. 2Na218O2+2H2O =4Na18OH+O2↑
B. 2KMnO4+5H218O2+3H2SO4 =K2SO4+2MnSO4+518O2↑+8H2O
C. NaH + 2H2O = NaOH + 2H2↑
D. K37ClO3+6HCl = K37Cl+3Cl2↑+3H2O
难度: 中等查看答案及解析
-
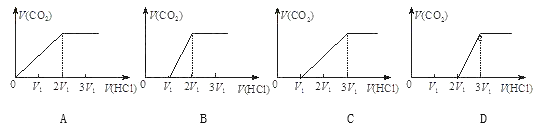
将一定质量的NaHCO3分为三等份,第一份直接加入盐酸中,消耗盐酸物质的量为n1,第二份首先加热,使其完全分解后,再加入盐酸中,消耗盐酸物质的量为n2,第三份首先加热,使其部分分解后,再加入盐酸中,消耗盐酸物质的量为n3,假若与盐酸都完全反应,则n1、n2、n3的大小关系正确的是( )
A. n1=n2=n3 B. n2>n1>n3 C. n1>n2>n3 D. n1>n3>n2
难度: 中等查看答案及解析
-
硫酸镁和硫酸铝溶液等体积混合后,铝离子浓度为0.1 mol/L,硫酸根离子的浓度为0.3 mol/L,则混合溶液中镁离子浓度为
A. 0.15 mol/L B. 0.3 mol/L
C. 0.45 mol/L D. 0.2 mol/L
难度: 简单查看答案及解析
-
相同质量的镁条分别在①氧气、②氮气、③二氧化碳中充分燃烧,所得固体物质的质量大小排列顺序正确的是( )
A. ①>②>③ B. ③>②>① C. ②>①>③ D. ③>①>②
难度: 中等查看答案及解析