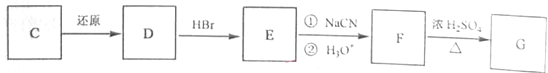
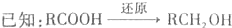-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂难度: 中等查看答案及解析
-
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe.有关该电池的下列说法中,正确的是( )
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS难度: 中等查看答案及解析
-
核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为
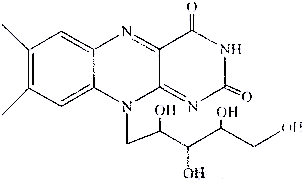
已知: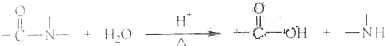
有关核黄素的下列说法中,不正确的是( )
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶液加碱后有NH3生成
D.能发生酯化反应难度: 中等查看答案及解析
-
下列关于实验原理或操作的叙述中,不正确的是( )
A.从碘水中提取单质碘时,不能用无水乙醇代替CCl4
B.可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油
C.纸层析实验中,须将滤纸上的试样点浸入展开剂中
D.实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法难度: 中等查看答案及解析
-
下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-38.6kJ•mol-1
C.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O=2Al(OH)4-难度: 中等查看答案及解析
-
某钠盐溶液中可能含有NO2-、SO42-、SO32-、CO32-、Cl-、I-等阴离子.某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中共含NO2-、CO32-、Cl-三种阴离子.请分析,该同学只需要完成上述哪几个实验,即可得出此结论.( )
A.①②④⑤
B.③④
C.③④⑤
D.②③⑤难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质
B.开发核能、太阳能等新能源,推广基础甲醇汽油,使用无磷洗涤剂都可直接降低碳排放
C.红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析
D.阴极射线、α-粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献难度: 中等查看答案及解析
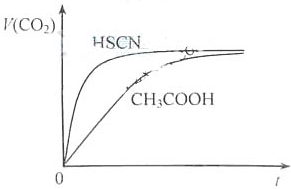

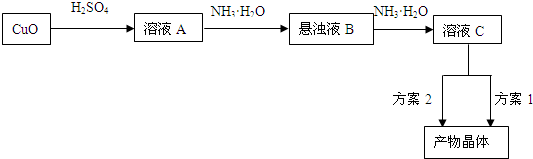
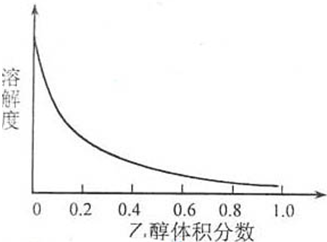
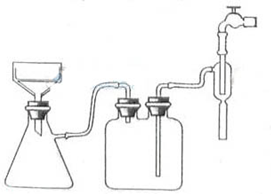
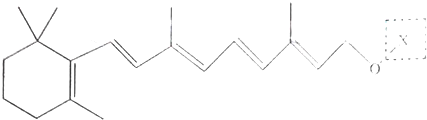
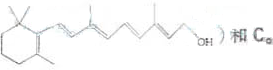 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.