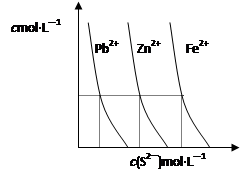-
已知:
①25℃时弱电解质电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10
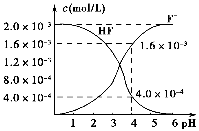
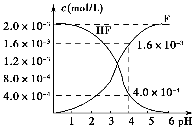
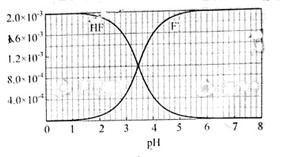
②25℃时,2.0×10-3mol•L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图所示:
请根据以下信息回答下旬问题:
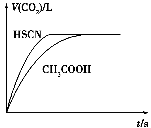
(1)25℃时,将20mL 0.10mol•L-1CH3COOH溶液和20mL 0.10mol•L-1HSCN溶液分别与20mL 0.10mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为:
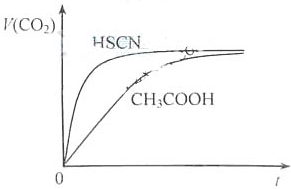
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是______,反应结束后所得两溶液中,c(CH3COO-)______c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈______,列式并说明得出该常数的理由______.
(3)4.0×10-3mol•L-1HF溶液与4.0×10-4 mol•L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.

-
已知25℃时弱电解质电离平衡常数:
Ka(CH3COOH) l.8 xl0-5,Ka(HSCN) 0.13
(1)将20mL,0.10mol/L CH3COOH溶液和20mL,0.10mol/L的HSCN溶液分别与0.10mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图。

反应开始时,两种溶液产生CO2的速率明显不同的原因是________;
反应结束后所得溶液中c(SCN-)____________c(CH3COO-)(填“>”,“=”或“<”)。
(2)2.0×l0-3mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-),c(HF)与溶液pH的关系如下图。
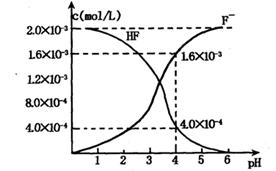
则25℃时,HF电离平衡常数为:(列式求值)Ka(HF)=________
(3)难溶物质CaF2溶度积常数为:Ksp= 1.5×10-10,将4.0×10-3mol/L HF溶液与4.0×l0-4 mol/L的CaCl2溶液等体积混合,调节溶液pH =4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?____________(填“有”或“没有”),筒述理由:________。
-
(创新预测题)已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与
时间t的关系如图所示。

反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)______c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:_____________________________________。
-
已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
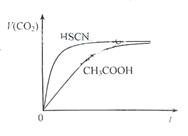
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图所示。
反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)________c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:____________________________________________。
-
(15分)已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
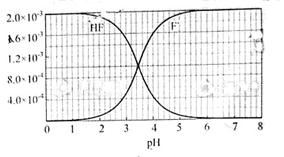
②25℃时, mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
请根据以下信息回答下旬问题: 图2
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是________,反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka ________,列式并说明得出该常数的理由________。
________,列式并说明得出该常数的理由________。
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
-
(16分)已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
②25℃时, mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下旬问题: 图2
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是________,反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka ________,列式并说明得出该常数的理由________。
________,列式并说明得出该常数的理由________。
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
-
已知25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10ˉ5,Ka(HSCN)=0.13。在物质的量浓度均为0.1 mol·Lˉ1的CH3COONa和NaSCN混合溶液中,下列排序正确的是
A. c(OHˉ)>c(CH3COOH )>c(HSCN )>c(H+)
B.c(OHˉ)>c(HSCN )>c(CH3COOH )>c(H+)
C. c(OHˉ)>c(SCNˉ)>c(CH3COOˉ)>c(H+)
D. c(OHˉ)>c(CH3COOˉ)>c(SCNˉ)>c(H+)
-
(1)已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
① 同温度下,等pH值的a. NaHCO3、b. NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为__________(填序号)。
② 25 ℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20ml0.1mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________反应结束后所得两溶液中,c(SCN-)________c(CH3COO-)(填“> ”、“< ”或“= ”)
③ 若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。己知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ mol-1
2NO2(g) N2O4(g) △H=-56.9kJ mol-1
N2O4(g) △H=-56.9kJ mol-1
H2O(g)=H2O(l) △H=-44.0kJ mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答下列问题:
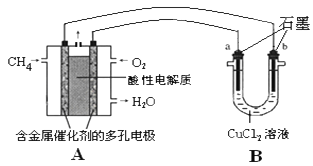
①甲烷燃料电池的负极反应式是____________
② 当A中消耗0.15mol氧气时.B 中____极增重_______g。
-
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
________(填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 ________ 。反应结束后所得两溶液中,c(CH3COO—)________c(SCN—)(填“>”、“<”或“=”)

③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kw d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是________(填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为________(填化学式)沉淀。
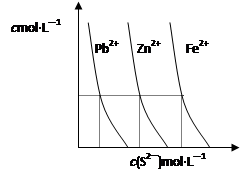
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:
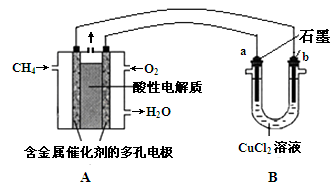
请回答:
① 甲烷燃料电池的负极反应式是________。
② 当线路中有0.1 mol电子通过时,________极增重________g
-
电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为______ ___。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 。
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-)
D.c(HCN)+ c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_____________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;电荷守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。