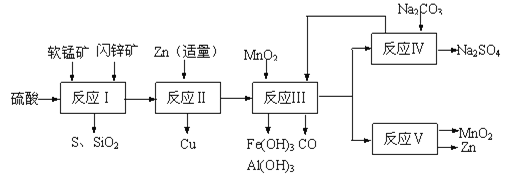
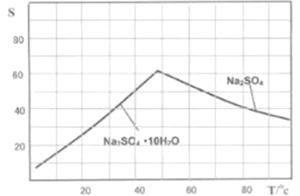
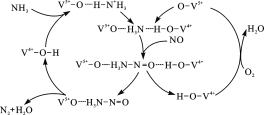
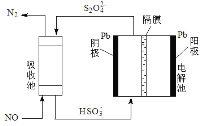
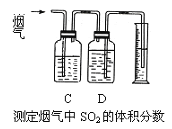
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A. 原子半径的大小顺序为W>Q>Z>X>Y
B. 元素X的气态氢化物与Q的单质可发生置换反应
C. 元素X与Y可以形成5种以上的化合物
D. 元素Q的最高价氧化物对应水化物的酸性比W的强
难度: 简单查看答案及解析
-
在离子浓度都为0.1 mol·L-1的下列溶液中,加入(或通入)某物质后,发生反应的先后顺序正确的是
A. 在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+
B. 在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32-
C. 在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32-
D. 在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+
难度: 困难查看答案及解析
-
古代的很多成语、谚语都蕴含着科学知识。下列对成语、谚语的解释正确的是
A. “甘之如饴”说明糖类均有甜味
B. “火树银花”中的焰火实质上是金属元素的焰色反应
C. “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高
D. “玉不琢,不成器”“百炼方能成钢”发生的均为化学变化
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法正确的是
A. 含有食品添加剂的食物对人体健康均有害
B. 玻璃和氮化硅陶瓷都属于新型无机非金属材料
C. 侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异
D. “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油
难度: 中等查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3 nm)恢复了磁性。“钴酞菁”分子的结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法中正确的是
A. “钴酞菁”分子能透过半透膜
B. 此项工作可以用来改变分子的某些物理性质
C. “钴酞菁”分子分散在水中所形成的分散系带电
D. “钴酞菁”分子分散在水中所形成的分散系为溶液
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,设计正确且能达到实验目的的是
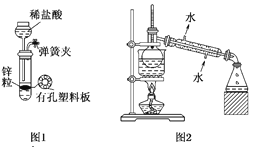
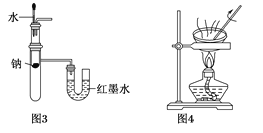
A. 用图1所示装置制取少量纯净的H2
B. 用图2所示装置分离K2CO3溶液和苯的混合物
C. 用图3所示装置验证Na和水反应的热效应
D. 用图4所示装置分离蒸干AlCl3 溶液制取无水AlCl3
难度: 中等查看答案及解析
-
在体积相同的两个密闭容器中分别充入O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
A. 两种气体的氧原子数目相等 B. 两种气体的压强相等
C. 两种气体的分子数目相等 D. O2比O3的质量小
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列有关说法中正确的是
A. 1 mol·L-1 Ca(ClO)2溶液中含ClO-的数目小于2NA
B. 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后容器中的N—H键数目3NA
C. 0.1 mol乙烯和乙醇(蒸气)的混合物完全燃烧所消耗的氧原子数0.6NA
D. 标准状况下,2.24 L 3517Cl2中含有的中子数目3.4NA
难度: 中等查看答案及解析
-
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
A. w=
×100% B. c=
C. 若上述溶液中再加入V mL水后,所得溶质的质量分数大于0.5w D. 若上述溶液与0.5V mL同浓度稀盐酸混合,则混合液中c(Cl-)>c(NH4+)
难度: 中等查看答案及解析
-
用如图装置研究电化学原理,下列分析中错误的是
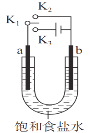
选项
连接
电极材料
分析
a
b
A
K1K2
石墨
铁
模拟铁的吸氧腐蚀
B
K1K2
锌
铁
模拟钢铁防护中牺牲阳极的阴极保护法
C
K1K3
石墨
铁
模拟电解饱和食盐水
D
K1K3
铁
石墨
模拟钢铁防护中外加电流的阴极保护法
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
现有甲、乙、丙、丁四种短周期元素,它们之间的关系如下:
Ⅰ.原子半径:甲<丙<乙<丁
Ⅱ.原子的最外层电子数:甲+丙=乙+丁=8
Ⅲ.原子的核外电子层数:丁>乙=丙=2甲
Ⅳ.乙元素的主要化合价:最高正价+最低负价=2
则下列说法不正确的是
A. 乙元素的最外层有5个电子,其氢化物含有极性键
B. 四种元素中丙的非金属性最强,其最高价氧化物对应的含氧酸酸性最强
C. 丁元素的氧化物对应的水化物与乙元素最高价氧化物对应水化物恰好完全反应形成的盐溶液显酸性
D. 乙、丙两元素形成的简单氢化物稳定性丙的强于乙
难度: 中等查看答案及解析
-
关于下图所示转化关系(X代表卤素)的说法不正确的是

A. 2H(g)+2X(g)
2HX(g) ΔH3<0
B. 途径Ⅰ生成HX的反应热与途径无关,所以ΔH1=ΔH2+ΔH3
C. Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D. 途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
难度: 困难查看答案及解析
-
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。如图为RFC工作原理示意图,下列有关说法正确的是
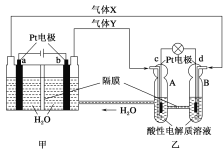
A. 图甲把化学能转化为电能,图乙把电能转化为化学能,水得到了循环使用
B. 当有0.1 mol电子转移时,a极产生0.56 L O2(标准状况下)
C. c极上发生的电极反应为O2+4H++4e-===2H2O
D. 图乙中电子从c极流向d极,提供电能
难度: 中等查看答案及解析
-
用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾。从开始通电时,收集B和C逸出的气体。1 min后测得B口的气体体积为C口处的一半,下列说法不正确的是
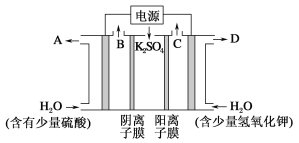
A. 电源左侧为正极
B. 电解槽左侧的电极反应方程式为2H2O-4e-==O2↑+4H+
C. D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大
D. 标准状况下,若1 min后从C口处收集到的气体比B口处收集到的气体多2.24 L,则有0.1NA个SO42-通过阴离子膜
难度: 中等查看答案及解析
-
将13.6gCu和Cu2O组成的混合物加入250 mL—定浓度的稀硝酸中,固体完全溶解生成Cu(NO3)2和NO。向所得溶液中加入1.0 L 0.5 mol • L-1的NaOH溶液,生成沉淀的质量为19.6 g,此时溶液呈中性,且金属离子(钠离子除外)沉淀完全。下列说法正确的是
A. 原固体混合物中,Cu和Cu2O的物质的量之比为1:1
B. 原稀硝酸的浓度为1.3 mol·L-1
C. 固体溶解后剩余硝酸的物质的量为0.1 mol
D. 产生的NO的体积为2.24L
难度: 中等查看答案及解析
-
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
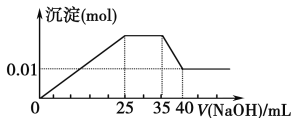
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=1∶1∶2
D. 实验所加的NaOH的浓度为2 mol·L-1
难度: 中等查看答案及解析