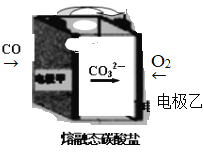
-
下列说法或表示方法中正确的是
A. 已知 2C(s) + 2O2 (g) = 2CO2(g) △H = a kJ/mol、2C(s) + O2(g) = 2CO(g) △H = b kJ/mol,则a > b
B. 甲烷的燃烧热为 890 kJ/mol,则甲烷燃烧的热化学方程式为 CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H = - 890 kJ/mol
C. 已知 P(s,白磷) = P(s,红磷) △H < 0,则白磷比红磷稳定
D. 已知 HCl(aq) + NaOH(aq) = Na Cl(aq) + H2O(l) △H = - 57.3 kJ/mol,则含 40.0 g NaOH 的稀溶液与稀醋酸完全中和,放出小于 57.3 kJ 的热量
难度: 中等查看答案及解析
-
下表中关于物质的分类组合,完全正确的是
选项
强电解质
弱电解质
非电解质
A
NaCl
C2H5OH
盐酸
B
HNO3
CaCO3
H2O
C
KMnO4
NH3·H2O
CO2
D
NaOH
BaSO4
Al
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
升高温度,下列数据不一定增大的是
A. 化学平衡常数 K
B. 水的离子积 Kw
C. 化学反应速率
D. 醋酸的电离平衡常数 Ka
难度: 中等查看答案及解析
-
下列说法正确的是
A. 所有氧化还原反应都可以设计成原电池
B. 泡沫灭火器中的原料通常是Al2(SO4)3溶液和NaHCO3溶液
C. 向Fe上镀Cu,应将粗铜与电源正极相连
D. 实验验证牺牲阳极的阴极保护法,在铁电极区滴加KSCN溶液用于检验电化学保护效果
难度: 中等查看答案及解析
-
下列操作会引起实验误差的是
A. 测定中和热的实验中,所使用的NaOH的物质的量稍大于HCl
B. 测定中和热的实验中,分多次将NaOH倒入盛HCl的小烧杯中
C. 酸碱中和滴定实验中,用蒸馏水洗净酸式滴定管后,再用标准盐酸润洗
D. 酸碱中和滴定实验中,用碱式滴定管取10.00 mL NaOH溶液放入洁净锥形瓶中,再加少量的蒸馏水进行滴定
难度: 中等查看答案及解析
-
某温度下,向pH = 6的蒸馏水中加入 KHSO4 固体,保持温度不变,测得溶液pH为2。对于该溶液,下列叙述不正确的是
A. 该温度高于 25℃
B. c(H+ ) = c(OH- ) + c(SO42- )
C. 由水电离出来的 c(H+) = 1×10-10 mol/L
D. 该温度下加入等体积 pH 为 12 的 KOH 溶液,可使反应后的溶液恰好呈中性
难度: 中等查看答案及解析
-
下列操作能达到预期目的是
选项
操作内容
操作目的
A
室温下,用pH试纸分别测定浓度均为0.1 mol·L-1的NaClO溶液和CH3COOH溶液的pH
比较HClO和 CH3COOH的酸性强弱
B
将FeCl2溶于稀盐酸中,并加入适量铁粉
配制FeCl2溶液
C
常温下,测得饱和溶液的pH:NaA>NaB
证明水解程度:A— > B—
D
常温下,等体积pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多
证明HB是强酸
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
一定条件下,在恒容密闭容器中,能表示反应X(s)+2Y(g)
2Z(g)一定达到化学平衡状态的
①容器中气体的密度不再发生变化 ②Y的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成2mol Z,同时消耗2mol Y
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
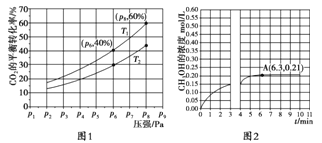
反应mA(s)+nB(g)
eC(g)+fD(g),△H=Q ,反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是

A. 达到平衡后,若升温,平衡正移
B. 化学方程式中m+n>e+f
C. 到平衡后,加入催化剂该反应△H减小
D. 达到平衡后,充入一定量C,平衡常数不变
难度: 中等查看答案及解析
-
硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析不正确的是
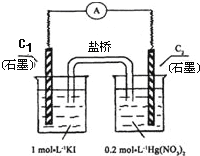
A. 如图装置的电流方向是从C2到C1
B. C1附近加入淀粉变蓝,C2析出固体
C. 可用饱和KI溶液—琼脂填充盐桥增强导电性
D. 该装置内发生的氧化还原反应可自发进行
难度: 中等查看答案及解析
-
锌空气燃料电池可用作电动车电源,电解质溶液为KOH溶液,正向放电,逆向充电,总反应为:Zn+O2+4OH-+2H2O
2Zn(OH)42-,下列说法正确的是
A. 充电时,电解质溶液中K+向阳极移动
B. 充电时,电解质溶液中c(OH-)逐渐减小
C. 放电时,负极反应为:Zn+4OH--2e-===Zn(OH) 42-
D. 可用盐酸代替KOH作电解液
难度: 中等查看答案及解析
-
对于平衡体系mA(g)+nB(g)
pC(g)+qD(g) ΔH<0,下列结论中不正确的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D. 若温度不变时,在恒容条件下充入稀有气体增大压强,该反应速率加快
难度: 中等查看答案及解析
-
一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g) + O2(g)
2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min
n(SO2)/mol
n(O2)/mol
0
2
1
5
1.2
10
0.4
15
0.8
下列说法不正确的是
A. 前5 min的平均反应速率为υ(SO2) = 0.08 mol/(L·min)
B. 保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和0.2 mol SO3(g)时,υ正> υ逆
C. 相同温度下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为40%
D. 保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ 的热量
难度: 中等查看答案及解析
-
在1 L K2SO4和CuSO4的混合溶液中c(SO42-)=2.0 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为
A. 1.5 mol·L-1 B. 2.0 mol·L-1
C. 1.0 mol·L-1 D. 0.50 mol·L-1
难度: 中等查看答案及解析
-
利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是
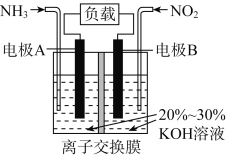
A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
难度: 困难查看答案及解析
-
常温下,Ka(HCOOH)>Ka(CH3COOH)=Kb(NH3·H2O),下列说法正确的是
A. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
B. 浓度均为0.1 mol·L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者
C. 0.2 mol·L-1 HCOOH与0.1 mol·L-1 NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D. 0.2 mol·L-1 CH3COONa与0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COOH) >c(Cl-)> c(CH3COO-)>c(H+)
难度: 困难查看答案及解析