-
中国传统诗词中蕴含着许多化学知识,下列分析不正确的是( )。
A. “日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象
B. “千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到
C. “爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应
D. “榆荚只能随柳絮,等闲缭乱走空园”,“柳絮”的主要成分为纤维素
难度: 中等查看答案及解析
-
下列关于物质分类正确的是
A. 油脂、蛋白质、淀粉均属于高分子
B. 氨水、氯化铵、次氯酸都属于电解质
C. 冰水混合物、盐酸、提纯后的胶体均为纯净物
D. 二氧化硅、二氧化硫、三氧化硫均为酸酐,也是酸性氧化物
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A. NA个氢氧化铁胶体粒子的质量为107g
B. 0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
C. 100g质量分数为17%的H2O2水溶液中含O―O键数目为NA
D. 2.7g铝与足量的稀硫酸和氢氧化钠分别反应,得到氢气的体积在标况下均为3.36L
难度: 中等查看答案及解析
-
化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是
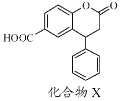
A. 不能与饱和Na2CO3溶液反应
B. 分子中所有原子可能处于同一平面
C. 在酸性条件下水解,水解产物只有一种
D. 1 mol化合物X最多能与8 mol H2发生加成反应
难度: 中等查看答案及解析
-
研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是

A. d为锌块,铁片不易被腐蚀
B. d为锌块,铁片上电极反应为2H++2e-==H2↑
C. d为石墨,铁片腐蚀加快
D. d为石墨,石墨上电极反应为O2+2H2O+4e-==4OH-
难度: 中等查看答案及解析
-
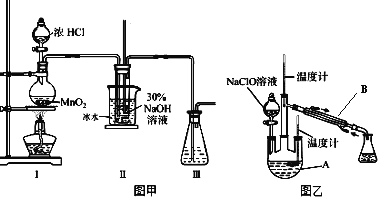
用下图所示实验装置进行相应实验,能达到实验目的的是
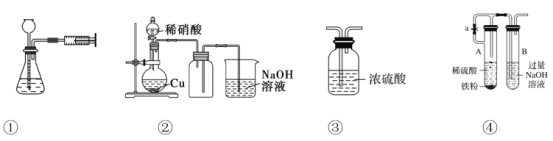
A. 用①所示的操作可检查装置的气密性
B. 用②所示的装置制取少量的NO
C. 用③所示的装置干燥H2、NH3、CO2等
D. 用④所示装置制取Fe(OH)2
难度: 中等查看答案及解析
-
某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液,逐滴加入氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5mL 0.2mol·L-1的盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g;
下列说法中正确的是
A. 该溶液中可能含有Cl-
B. 该溶液中一定含有K+、AlO2-、CO32-、Cl-
C. 步骤②中产生的白色沉淀为硅酸
D. 该溶液是否有K+需做焰色反应实验 (透过蓝色钴玻璃片)
难度: 中等查看答案及解析