-
下列物质中属于强电解质的是( )
A.NH3•H2O
B.H2O
C.CH3COOH
D.醋酸铵难度: 中等查看答案及解析
-
下列电离方程式中书写正确的是( )
A.NaHSO4⇌Na++H++SO42-
B.NaHCO3⇌Na++H++CO32-
C.HClO=H++ClO-
D.H2S⇌H++HS-;HS-⇌H++S2-难度: 中等查看答案及解析
-
下列各组离子能在PH=0的无色溶液中大量共存的是( )
A.Mg2+、Cl-、Na+、SO42-
B.Ba2+、Na+、NO3-、MnO4-
C.K+、Cl-、HCO3-、NO3-
D.Ca2+、Na+、Fe3+、CO32-难度: 中等查看答案及解析
-
常温下,纯水中存在电离平衡:H2O⇌H++OH-.欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是( )
A.H2SO4
B.AlCl3
C.NaHCO3
D.NaOH难度: 中等查看答案及解析
-
下列溶液加热蒸干、灼烧后,能析出原溶质固体的是( )
A.AlCl3
B.KHCO3
C.Fe2(SO4)3
D.NH4HCO3难度: 中等查看答案及解析
-
1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为( )
A.C+H2O═CO+H2△H=+131.28kJ•mol-1
B.C(s)+H2O(g)═CO(g)+H2(g)△H=+10.94 kJ•mol-1
C.C(s)+H2O(l)═CO(g)+H2(g)△H=+131.28kJ•mol-1
D.C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ•mol-1难度: 中等查看答案及解析
-
人造地球卫星用到的一种高能电池--银锌蓄电池,它在放电时的电极反应为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,下列叙述中,正确的是( )
A.Ag2O 是负极,并被氧化
B.电流由锌经外电路流向氧化银
C.工作时,负极区溶液pH减小,正极区pH增大
D.溶液中OH-向正极移动,K+、H+向负极移动难度: 中等查看答案及解析
-
在0.1mol•L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
A.温度升高,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol•L-1 HCl溶液,溶液中c(H+)减小
D.加入少量醋酸钠固体,CH3COOH溶液的电离度增大难度: 中等查看答案及解析
-
恒容密闭容器中进行的可逆反应2NO2⇌2NO+O2,达到平衡状态的是( )
①单位时间内生成a mol O2的同时生成2a mol NO2
②单位时间内生成a mol O2的同时生成2a mol NO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
A.①③⑤
B.②④⑤
C.①③④
D.①②③④⑤难度: 中等查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是(提示BaSO4(s)⇌Ba2+(aq)+SO42-(aq)的平衡常数Ksp=[Ba2+]•[SO42-],称为溶度积常数)( )
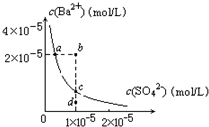
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp难度: 中等查看答案及解析
-
反应:①PCl5(g)⇌PCl3(g)+Cl2(g) ②2HI(g)⇌H2(g)+I2(g) ③2NO2(g)⇌N2O4(g)在一定条件下,达到化学平衡时,反应物的转化率均是 a%.若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率( )
A.均不变
B.①增大,②不变,③减少
C.①减少,②不变,③增大
D.均增大难度: 中等查看答案及解析
-
一个电池的总反应:Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
A B C D 正极 Zn Cu Cu Ag 负极 Cu Zn Zn Cu 电解质溶液 CuCl2 H2SO4 CuSO4 AgNO3
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列各组数据中,其比值为2:1的是( )
A.pH=7的氨水与(NH4)2SO4的混合液中,c(NH)与c(SO
)之比
B.相同温度下,0.2 mol•L-1HCOOH溶液与0.1 mol•L-1HCOOH溶液中c(H+)之比
C.Na2CO3溶液中,c(Na+)与c(CO)之比
D.pH=12的KOH溶液与pH=12的Ba(OH)2溶液的物质的量浓度之比难度: 中等查看答案及解析
-
相同温度下,100mL 0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量
B.c(H+)
C.c(OH-)
D.c(CH3COOH)难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)⇌2C(g)△H>0,下列图象中正确的是( )
A.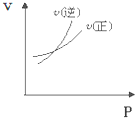
B.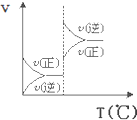
C.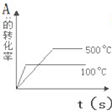
D.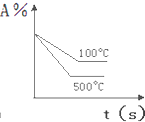
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.pH=2与pH=1的硝酸中c(H+)之比为1:10
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中增大
难度: 中等查看答案及解析
-
有物质的量浓度均为0.1mol•L-1 的①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25mL,下列说法正确的是( )
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL 0.1mol•L-1盐酸后,pH最大的是①
D.若升高温度,则②的pH增大难度: 中等查看答案及解析
-
常温下,下列溶液中各离子浓度关系正确的是( )
A.等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c
B.浓度为0.1 mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
C.pH=12的氨水与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)难度: 中等查看答案及解析
-
常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是( )
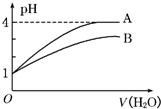
A.A酸比B酸的电离程度小
B.B酸比A酸容易电离
C.A是强酸,B是弱酸
D.pH=1时,B酸的物质的量浓度比A酸大难度: 中等查看答案及解析
-
草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol•L-1NaHC2O4溶液中滴加0.01mol•L-1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH)=0时,c(H+)=1×10-2mol•L-1
B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4- )
C.V(NaOH)=10 mL时,c(H+)=1×10-7mol•L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )难度: 中等查看答案及解析