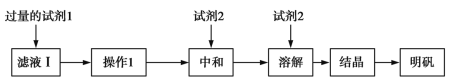
-
常温下,在下列给定条件的溶液中,一定能大量共存的离子组是
A. Kw/c(H+)=0.1mol/L的溶液:Na+、K+、SiO32-、NO3-
B. 加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3-
C. c(Fe3+)=0.1mo/L的溶液:NO3-、Al3+、Cl-、CO32-
D. 能使pH试纸呈红色的溶液:Na+、NH4+、Fe2+、NO3-
难度: 中等查看答案及解析
-
下列说法正确的是
A. 化学反应能够制造出新的物质,也能制造出新的元素
B. 明矾水解时产生的胶体粒子,可作漂白剂
C. 食品包装袋中常放入小袋的生石灰,防止食品氧化变质
D. 河流入海口处会形成三角洲,其原理与卤水点豆腐相似
难度: 中等查看答案及解析
-
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
A. 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物
B. HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸
C. 漂白粉、福尔马林、冰水、王水、氯水均为混合物
D. Na2O、NaOH、Na2CO3、NaCl都属于钠的含氧化合物
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 《黄白第十大》中“曾青涂铁,铁赤如铜”主要发生了置换反应
B. 《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,利用到蒸馏
C. 唐代《真元妙道要略》中有云“以硫磺、雄黄合硝石并蜜烧之,焰起烧手、面及屋舍者”,描述了硫磺熏制过程
D. “所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”过程包括了溶解、蒸发、结晶等操作
难度: 简单查看答案及解析
-
下列化学用语或模型图正确的是
A. 氮气的结构式:
B. 用电子式表示溴化氢的形成过程为:
C. CO2的比例模型:
D. 14C的原子结构示意图
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数值。下列有关叙述正确的是( )
A. 10g 46%的乙醇水溶液中,氧原子的个数为0.4NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 14 g乙烯和丙烯混合气体中的氢原子数为NA
难度: 中等查看答案及解析
-
下列实验操作及现象能够达成相应实验目的的是
实验目的
实验操作及现象
A
检验Na2SO3溶液是否变质
向Na2SO3溶液中加入Ba(NO3)2溶液,出现白色沉淀,再加入稀硝酸,沉淀不溶解
B
证明酸性条件下H2O2氧化性强于I2
向淀粉KI溶液中滴入3滴稀硫酸,未见溶液变蓝;再加入10%的H2O2溶液,溶液立即变蓝色
C
证明碳的非金属性强于硅
将浓盐酸滴入碳酸钠固体中,生成的气体通入盛有水玻璃的试管中,出现浑浊
D
向某溶液中滴入氯水,再滴加KSCN溶液显红色
原溶液中一定有Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 淀粉、纤维素水解的最终产物均为葡萄糖
B. 葡萄糖既可以与银氨溶液反应,又可以与新制氢氧化铜悬浊液反应
C. 糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应
D. 天然油脂没有固定的熔点和沸点,所以天然油脂是混合物
难度: 简单查看答案及解析
-
有机物甲、乙的结构如图所示。下列说法错误的是
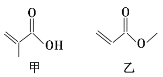
A. 甲、乙都能与溴的单质发生加成反应
B. 甲、乙互为同分异构体
C. 一定条件下,甲、乙均能发生取代反应
D. 甲、乙都能与金属钠反应生成氢气
难度: 中等查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是 ( )
选项
已知
类推
A
向Ca(OH)2悬浊液中通入Cl2:
Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O
向CaCO3悬浊液中通入Cl2:
Cl2+CaCO3=Ca2++Cl-+ClO-+CO2↑
B
向氯化铝溶液中加入足量NaOH溶液:
Al3++4OH-=[Al(OH)4]-
向氯化铝溶液中加入足量氨水:
Al3++4NH3·H2O=[Al(OH)4]-+H2O+4NH4+
C
FeCl2溶液中滴入氯水:
2Fe2++Cl2===2Fe3++2Cl-
向FeCl2溶液中滴入碘水:
2Fe2++I2===2Fe3++2I-
D
向Ca(OH)2溶液中通入过量CO2:
CO2+OH-===HCO3-
向Ca(OH)2溶液中通入过量SO2:
SO2+OH-===HSO3-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图所示原电池,盐桥中装有饱和K2SO4溶液。下列说法正确的是
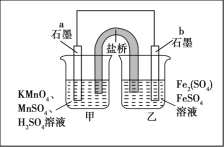
A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为MnO4-+8H++5e-=Mn2++4H2O
难度: 困难查看答案及解析
-
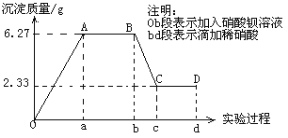
如图是实验室硫酸试剂标签上的部分内容,据此下列说法正确的是( )

A. 配制稀硫酸定容时俯视刻度线会造成所配溶液浓度偏高
B. 取该硫酸1ml与1ml水混合后,物质的量浓度为9.2mol/L
C. 将该硫酸配成1mol/L的稀硫酸480ml所需的玻璃仪器只有:烧杯、500ml容量瓶、玻璃棒
D. 1molFe与足量的该硫酸反应产生1mol氢气
难度: 中等查看答案及解析
-
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、[Al(OH)4]-中的若干种离子,离子浓度均为0.1mol·L-1,某同学进行了如下实验,下列说法正确的是
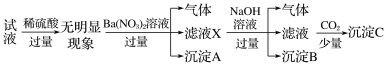
A. 无法确定原试液中是否含有Al3+、Cl-
B. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
C. 无法确定沉淀C的成分
D. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
难度: 困难查看答案及解析
-
下列事实与平衡移动原理无关的是
A. 向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅
B. 加热MgCl2·6H2O固体最终得到Mg(OH)Cl
C. 将FeS2矿石粉碎更有利于焙烧制备SO2气体
D. NO2气体经过冷凝和加压成无色液体
难度: 中等查看答案及解析
-
CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)
CO2(g)+H2(g),得到如下三组数据:
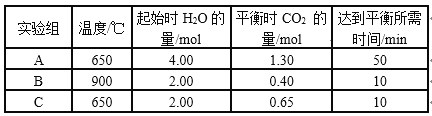
下列说法不正确的是
A. 从实验数据分析,该反应的正反应是吸热反应
B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1
C. 从生产效益分析,C组实验的条件最佳
D. 比较实验B、C,说明C实验使用了更高效的催化剂
难度: 中等查看答案及解析