-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是
A. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B. 原子半径大小:X<Y,Z>W
C. 化合物Z2Y和ZWY3都只存在离子键
D. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
难度: 中等查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项
事实
推测
A
12Mg与水反应缓慢,20Ca与水反应较快
56Ba(第ⅡA族)与水反应会更快
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可作半导体材料
C
HCl在1 500 ℃时分解,HI在230 ℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列除杂试剂的选择或除杂操作正确的是
选项
括号内为杂质
除杂试剂
除杂操作
A
CO2(SO2)
Na2CO3溶液.
将气体通过足量的Na2CO3溶液
B
Na2O2(Na2O)固体
O2
在纯氧气中加热
C
FeCl3溶液(CuCl2)
Fe粉
加入过量Fe粉,充分反应后过滤
D
Na2SO4溶液(Na2CO3)
盐酸
加入盐酸至不再产生气泡为止
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与材料、生活和环境密切相关,下列有关说法中正确的是 ( )
A. 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质
B. “绿色化学”的核心是应用化学原理对环境污染进行治理
C. 推广使用煤液化技术,可减少二氧化碳等温室气体的排放
D. 新能源汽车的推广与使用,有助于减少光化学烟雾的产生
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. HF、HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
B. Ba(OH)2晶体中既存在离子键又有共价键
C. SiO2属于原子晶体,熔化破坏共价键和分子间作用力
D. 干冰升华时,分子内共价键会发生断裂
难度: 中等查看答案及解析
-
2018年初春,雾霾天气对环境造成了严重影响,部分城市开展PM2.5和臭氧的监测。下列有关说法正确的是( )
A. 臭氧的摩尔质量是48g
B. 同温同压条件下,等质量的氧气和臭氧体积比为3∶2
C. 48g臭氧的体积为 22.4L
D. 1.00 mol臭氧中含有电子总数为18×6.02×1023
难度: 中等查看答案及解析
-
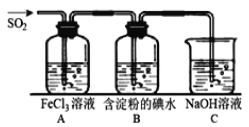
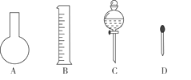
下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
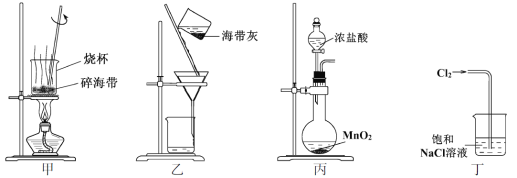
A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I−的Cl2
D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气
难度: 中等查看答案及解析
-
关于Na2O2的叙述正确的是 (NA表示阿伏伽德罗常数)
A.7.8g Na2O2含有的共价键数为0.2NA
B.7.8 g Na2S与Na2O2的混合物, 含离子总数为0.3 NA
C.7.8g Na2O2与足量的CO2充分反应, 转移的电数为0.2NA
D.0.2 mol Na被完全氧化生成7.8g Na2O2, 转移电子的数目为0.4NA
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 101 kPa时,2H2(g)+O2(g)==2H2O(l) ΔH=-572 kJ·mol-1,则H2的燃烧热为572 kJ·mol-1
B. 已知稀溶液中,H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ·mol-1,则稀盐酸与稀氨水溶液反应生成1 mol水时放出57.3 kJ的热量。
C. 若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多。
D. 已知:2C(s)+2O2(g)=2CO2(g) ΔH1 ;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1 <ΔH2
难度: 中等查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是( )
选项
实验目的
实验操作
A
称取2.0g NaOH固体
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B
配制0.1mol·L−1 NaCl溶液100mL
将NaCl固体溶解于100mL蒸馏水即可
C
测定中和热的实验中,为了加快反应速率,减小实验误差
使用环形玻璃搅拌棒上下搅拌
D
检验溶液中是否含有Br
取少量试液于试管中,加入CCl4并振荡,静置,观察CCl4层的颜色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下表中评价合理的是( )
选项
化学反应及其离子方程式
评 价
A
Fe3O4与稀硝酸反应:2Fe3O4+18H+===6Fe3++H2↑+8H2O
正确
B
向碳酸镁中加入稀盐酸:CO32-+2H+===CO2↑+H2O
错误,碳酸镁不应写成离子形式
C
向硫酸铝溶液中加入少量氢氧化钡溶液:Ba2++SO42-===BaSO4↓
正确
D
FeBr2溶液与过量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2
正确
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列指定微粒的数目不相等的是( )
A. 等物质的量的水与重水含有的中子数
B. 等质量的乙烯和丙烯中含有的共用电子对数
C. 同温、同压、同体积的14CO和NO含有的质量数
D. 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数
难度: 简单查看答案及解析
-
将2a L Al2(SO4)3和(NH4)2SO4的混合溶液分为两等份,其中一份加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;另一份加入足量强碱并加热可得到c mol NH3气体,则原混合溶液中的Al3+浓度(mol/L)为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
选项
实验操作
现象
结论
A
分别加热Na2CO3和NaHCO3固体
试管内壁都有水珠
两种物质均受热分解
B
将可调高度的铜丝伸入到稀HNO3中
溶液变蓝
Cu与稀HNO3发生置换反应
C
向含I- 的无色溶液中滴加少量新制氯水,再滴加淀粉溶液
加入淀粉后溶液变成蓝色
氧化性:Cl2>I2
D
向某溶液中先滴加H2O2溶液,再滴入KSCN溶液
溶液变成血红色
原溶液一定含有Fe3+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 标准状况下,22.4L CCl4中含有的共价键数为4NA
B. 0.2mol NO和0.lmol O2充分反应后,混合物的分子数为0.2NA
C. 64g铜丝加热下在硫磺蒸气里完全反应后,失去的电子数为NA
D. 1 mol·L-1 Ca(ClO)2溶液中含ClO-的数目为2NA
难度: 中等查看答案及解析
-
中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:
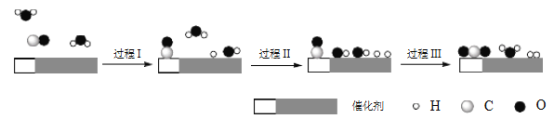
下列说法正确的是
A. 过程Ⅰ、过程Ⅲ均为放热过程
B. 过程Ⅲ生成了具有极性共价键的H2、CO2
C. 使用催化剂降低了水煤气变换反应的ΔH
D. 图示过程中的H2O均参与了反应过程
难度: 中等查看答案及解析
-
已知:①向KMnO4固体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸变蓝。下列判断正确的是( )
A. 上述实验证明氧化性:MnO4- > Cl2 > Fe3+ > I2
B. 上述实验中,共有两个氧化还原反应
C. 实验①生成的气体和SO2同时通入水中,可以增强漂白效果
D. 实验②证明Fe2+既有氧化性又有还原性
难度: 中等查看答案及解析
-
标准状况下V L氨气溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的物质的量浓度为c mol·L-1,密度为ρg·mL-1,质量分数为ω,则下列关系中不正确的是( )
A. ρ=
B. ω=17c/1000ρ
C. ω=17V/(17V +22400) D. C =1000Vρ/(17V + 22400)
难度: 中等查看答案及解析
-
为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
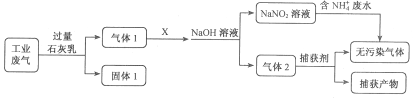
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
难度: 中等查看答案及解析