-
关于pH都等于9的两种溶液:①NaOH溶液 ②CH3COONa溶液,下列说法正确的是
A. 加水稀释相同倍数后溶液的pH:①=②
B. 由水电离产生的OH-物质的量浓度:①>②
C. 升高相同温度后,溶液pH:①=②
D. 两种溶液中的Na+物质的量浓度:①<②
难度: 中等查看答案及解析
-
下列对能源的说法中不正确的是
A. 化学能是能量的一种形式,它不仅可以转化为热能,也能转化为电能或光能
B. 为了应对能源危机,应加大煤、石油等化石能源的开采,满足发展需求
C. 大力推广新能源汽车,建设绿色低碳的交通体系
D. 氢能具有燃烧热值高,资源丰富的优点,目前氢已用作火箭和燃料电池的燃料
难度: 简单查看答案及解析
-
下列对于化学反应进行的方向理解正确的是
A. 同种物质在气态时熵值最小,固态时最大
B. 在密闭条件下,体系可以自发的从无序变为有序
C. 大理石在常温下能够自发分解
D. 虽然硝酸铵溶于水要吸热,但它能够自发的向水中扩散
难度: 简单查看答案及解析
-
如图所示是25℃时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
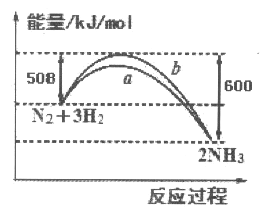
A. 该反应为放热反应
B. b曲线是表示加入了催化剂时的能量变化曲线
C. 加入催化剂,增加了反应的热效应
D. 反应开始通入1 mol N2和3 mol H2,反应后放出的热量一定为92kJ
难度: 简单查看答案及解析
-
25 ℃和101 kPa时,反应 2A(g)=4B(g)+C(g) △H =+56.76kJ/mol,能够自发进行,其原因可能是
A. 是熵减少的反应 B. 是放热反应 C. 是吸热反应 D. 熵增大效应大于能量效应
难度: 中等查看答案及解析
-
下列各式中属于正确的水解反应离子方程式的是
A. CH3COO-+H2O
CH3COOH+OH- B. S2-+H3O+
HS-+H2O
C. CO32-+2H2O
H2CO3+2OH- D. HCO3-+OH- = CO32-+H2O
难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是
A. 纯碱溶液去油污
B. 铁在潮湿的环境下生锈
C. 用氯化铁溶液制氢氧化铁胶体
D. 利用明矾溶液的酸性可清除铜制品表面的铜锈
难度: 简单查看答案及解析
-
在0.1 mol•L−1CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO- + H+,对于该平衡,下列叙述正确的是
A. 加热,平衡向逆反应方向移动
B. 加入少量0.05 mol•L﹣1 H2SO4溶液,溶液中c(H+)不变
C. 加入少量NaOH固体,平衡向正反应方向移动
D. 加入少量水,水的电离平衡不移动
难度: 中等查看答案及解析
-
在1L密闭容器中进行如下反应:X(g)+3Y(g)
2Z(g),达到平衡时 X、Y、Z的物质的量分别为 0.1mol、0.3mol、0.2mol,保持温度和容器体积不变时,再向容器中充入X、Y、Z的物质的量0.1mol、0.3mol、0.2mol,则下列说法正确的是
A. 化学平衡常数不变,平衡不移动 B. 向正反应方向移动
C. 向逆反应方向移动 D. 容器内压强始终保持原来的2倍
难度: 困难查看答案及解析
-
下列生产、生活等实际应用,能用勒夏特列原理解释的是
A. 加入催化剂有利于合成氨的反应
B. 500 ℃比室温更有利于合成氨的反应(已知合成氨反应是放热反应)
C. 由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深
D. 阴暗处密封有利于氯水的储存
难度: 中等查看答案及解析
-
下列装置或操作正确且能达到实验目的的是
A.
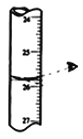 读取滴定管读数 B.
读取滴定管读数 B. 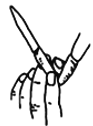 排除滴定管内气泡
排除滴定管内气泡C.
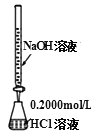 酸碱中和滴定 D.
酸碱中和滴定 D. 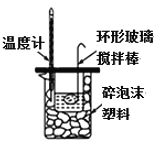 中和热的测定
中和热的测定难度: 简单查看答案及解析
-
已知室温时Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
A. BaCO3、BaSO4均不溶于水,所以均可以做胃病患者的钡餐试剂(提示:可溶性重金属钡盐是剧毒物质)
B. 虽然BaSO4和BaCO3溶解度相差较小,但BaCO3可以转化为BaSO4
C. 室温下,饱和BaSO4和BaCO3混合溶液中,c(SO42-)/c(CO32-)=4.4×10-2
D. 分别用等体积的水和0.010 mol/L硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大
难度: 中等查看答案及解析
-
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)
2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程(I、Ⅱ)如图所示。下列说法中不正确的是
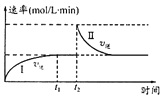
A. t0~t1时,v(正)>v(逆)
B. I、Ⅱ两过程分别达到平衡时,A的体积分数Ⅰ=Ⅱ
C. t2 时刻改变的条件可能是向密闭容器中加A物质
D. Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ=Ⅱ
难度: 中等查看答案及解析
-
常温下,下列溶液中各离子浓度关系正确的是
A. pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 浓度为0.1 mol·L-1的碳酸氢钠溶液:c(Na+)+ c(H+)=c(HCO3-)+c(OH-)
C. 浓度为0.1 mol·L-1的(NH4)2CO3溶液:c(NH4+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D. 浓度均为0.1 mol·L-1的醋酸溶液与NaOH溶液混合后:c(OH-)=c(H+)+c(CH3COOH)
难度: 困难查看答案及解析
-
在恒容密闭容器中通入X并发生反应:2X(g)
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
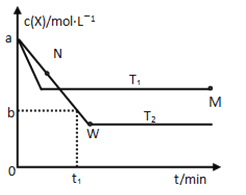
A. T1>T2 △H > 0
B. 该反应进行到M点放出的热量等于进行到W点放出的热量
C. M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D. M点时再加入一定量X,平衡后X的转化率减小
难度: 中等查看答案及解析
-
下列说法正确的是
A. 任何酸与碱发生中和反应生成1mo1H2O的过程中,能量变化均相同
B. 已知:① C(s石墨)+O2(g)=CO2(g) △H1=-393.5 kJ/mol② C(s金刚石)+O2(g)=CO2(g) △H2=-395.0 kJ/mol,则金刚石比石墨稳定
C. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
D. 表示硫的燃烧热的热化学方程式:S(s) +3/2O2(g)=SO3(g);△H=-315kJ/mol
难度: 中等查看答案及解析
-
下列设计的实验方案能达到实验目的的是
A. 制取无水AlCl3:将AlCl3溶液加热蒸干并灼烧
B. 除去锅炉水垢中含有的CaSO4:先用Na2CO3溶液处理,然后再加酸去除
C. 证明氨水中存在电离平衡:向滴有酚酞的氨水中加入少量NH4Cl固体,溶液红色变浅
D. 配制FeCl3溶液时为防止溶液浑浊常加入少量稀硫酸
难度: 中等查看答案及解析
-
25℃时,向20 mL 0.01 mol·L-1HA(aq)中不断滴入0.02 mol·L-1 NaOH(aq),混合溶液pH变化如图所示。此过程溶液下列说法不正确的是(已知:25℃时一元酸HA(aq)电离平衡常数Ka=1.6×10-5)

A. a点溶液的pH大于3
B. b点溶液中离子:c(A-)>c(Na+)>c(H+)>c(OH-)
C. c点表示酸HA(aq)和NaOH(aq)溶液恰好完全反应
D. d点溶液加水稀释后c(H+)/c(HA)的值会增大
难度: 困难查看答案及解析