-
X、Y、Z是中学化学常见的三种有色物质(其组成元素均属于短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。下列说法正确的是
A. X、Y、Z中,只有Y能使湿润的淀粉-碘化钾试纸变蓝
B. 1 mol Y或Z与足量水完全反应时,均转移2 mol电子
C. Z为离子化合物,但含有非极性键,阴、阳离子个数比为1 : 2
D. X和Y均能用向上排空气法和排水法收集
难度: 中等查看答案及解析
-
读下列药品标签,有关分析不正确的是
选项
A
B
C
D
物品标签




分析
该试剂应装在橡胶塞的细口瓶中
该药品不能与皮肤直接接触
该物质受热易分解
该药品物质的量浓度为18.4 mol·L-1
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,下列说法正确的是

A. 气球②中装的是O2
B. 气球①和③中分子数相等
C. 气球①和④中气体物质的量之比为4︰1
D. 气球③和④中气体密度之比为2︰1
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是
A. 加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,SO42-
B. 含有NaClO的溶液中:K+,Al3+,Br-,S2-
C. 澄清透明溶液:Cu2+,SO42-,HCO3-,H+
D. 使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42-
难度: 中等查看答案及解析
-
下列热化学方程式正确的是( )(注:ΔH的绝对值均正确)
A. C2H5OH(l) + 3O2(g) ===2CO2(g) + 3H2O(g) ΔH=-1367.0 kJ/mol(燃烧热)
B. NaOH(s)+ HCl(aq) ===NaCl(aq) + H2O(l) ΔH=-57.3kJ/mol(中和热)
C. S(s) + O2(g) ===SO2(g) ΔH=-269.8kJ/mol(反应热)
D. 2NO2===O2 + 2NO ΔH=+116.2kJ/mol(反应热)
难度: 中等查看答案及解析
-
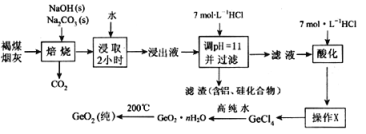
下列解释物质用途或现象的反应方程式不准确的是
A. 硫酸型酸雨的形成会涉及反应2H2SO3+O2====2H2SO4
B. 工业上制取粗硅的化学方程式:SiO2+C
Si+CO2↑
C. Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O
D. 成分为盐酸的“洁厕灵”与“84消毒液”混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A. 1mol/L的Ca(ClO)2溶液中含ClO-数目为2NA
B. 24.5 L氢气中所含氢原子数一定大于2NA
C. 体积分别为1.0L pH=2的盐酸与硫酸溶液中氢离子数均为0.01NA
D. 1 mol -OH与1 molOH-所含电子数均为9 NA
难度: 中等查看答案及解析
-
H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是
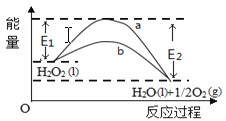
A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJ•mol-1
难度: 中等查看答案及解析
-
向分别含SO32-、Fe2+、Br-、I-各0.1mol的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是
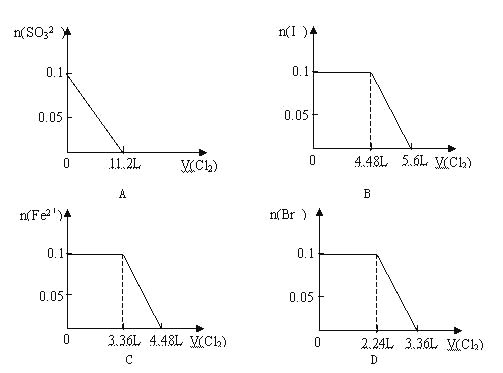
难度: 中等查看答案及解析
-
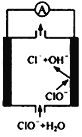
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
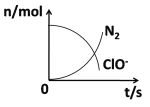
A.还原剂是含CN-的物质,氧化产物只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为4:1
D.标准状况下,若生成2.24LN2,则转移电子数为NA
难度: 困难查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法不正确的是( )
A. 原子半径Z<M
B. 非金属性:X<Z
C. M元素最高价氧化物对应水化物具有两性
D. Y的最高价氧化物对应水化物的酸性比X的弱
难度: 中等查看答案及解析
-
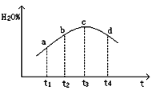
用pH传感器测得0.10mol/LNa2CO3溶液从55℃升高至85℃的pH如图所示。在55℃升高至85℃升温过程中,下列说法正确的是( )
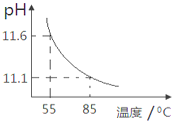
A.c(H+)增大,c(OH-)减小 B.c(CO32-)/c(HCO3-)比值不断增大
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.10 D.c(OH-)-c(HCO3-)-c(H2CO3)=10-11.1
难度: 困难查看答案及解析
-
在一定温度下,某浓度的硝酸与金属锌反应生成NO2和NO,两者的物质的量之比为1∶3,则要使1 mol金属锌完全反应,反应过程中消耗HNO3的物质的量为( )
A. 2.4 mol B. 2.6 mol
C. 2.8 mol D. 3.2 mol
难度: 中等查看答案及解析
-
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)
CH3OCH3(g)+H2O(g)
容器
编号温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
I
387
0.20
0.080
0.080
Ⅱ
387
0.40
Ⅲ
207
0.20
0.090
0.090
下列说法正确的是
A. 该反应的正方应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C. 容器I中反应达到平衡所需时间比容器Ⅲ中的长
D. 若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
难度: 中等查看答案及解析