-
下列热化学方程式中△H代表燃烧热的是( )
A. CH4(g)+3/2O2(g)=2H2O(l)+CO(g) △H1
B. S(s)+3/2O2(g)=SO3(s) △H2
C. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3
D. 2CO(g)+O2(g)=2CO2(g) △H4
难度: 中等查看答案及解析
-
少量铁片与l00 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A. ①⑥⑦ B. ③⑤⑧ C. ③⑦⑧ D. ③④⑥⑦⑧
难度: 中等查看答案及解析
-
下列事实不能用化学平衡移动原理解释的是
A. 光照新制的氯水时,溶液的pH逐渐减小
B. 加催化剂,使N2和H2在一定条件下转化为NH3
C. 可用浓氨水和氢氧化钠固体快速制取氨气
D. 增大压强,有利于SO2和O2反应生成SO3
难度: 中等查看答案及解析
-
下列方程式书写正确的是
A. NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO4-
B. H2SO3的电离方程式:H2SO3
2H++SO32-
C. CO32-的水解方程式:CO32-+H2O
HCO3-+OH-
D. CaCO3沉淀溶解平衡方程式:CaCO3(s)===Ca2+(aq)+CO32-(aq)
难度: 简单查看答案及解析
-
下列事实能说明亚硝酸是弱电解质的是
①25 ℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1 mol·L-1 HNO2溶液的pH=2.1
A. ①②③ B. ②③④ C. ①④ D. ①②④
难度: 中等查看答案及解析
-
由水电离出的c(OH—)=1×10—13 mol·L—1的无色溶液中,一定能大量共存的离子组是
A. Cl—、HCO3—、Na+、K+
B. Fe3+、NO3—、K+、H+
C. NO3—、Ba2+、K+、Cl—
D. Al3+、SO42—、NH4+、Cl—
难度: 简单查看答案及解析
-
将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和,各溶液中Ba2+的浓度最小的为
A. 10 mL 0.2 mol/LNa2CO3溶液 B. 40 mL水
C. 50 mL 0.01 mol/L 氯化钡溶液 D. 100 mL 0.01 mol/L盐酸
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
B. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D. ΔH<0、ΔS>0的反应在任何温度下都能自发进行
难度: 中等查看答案及解析
-
已知反应:2NO(g)+Br2(g)=2NOBr(g)的活化能为a kJ/mol,其反应机理如下:
①NO(g)+Br2(g)=NOBr2(g) 慢
②NO(g)+NOBr2(g)=2NOBr(g) 快
下列有关该反应的说法正确的是
A.反应的速率主要取决于②的快慢 B.反应速率v(NO)=v(NOBr)=2v(Br2)
C.NOBr2是该反应的催化剂 D.该反应的焓变等于a kJ/mol
难度: 中等查看答案及解析
-
下列各项中的两个量,其比值一定为2∶1的是
A. 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积
B. 相同温度下,0.2 mol·L-1醋酸溶液和0.1 mol·L-1醋酸溶液中的c(H+)
C. 在(NH4)2SO4溶液中,c(NH4+)与c(SO42-)
D. 相同温度下,等浓度的Ba(OH)2和NaOH溶液中的c(OH-)
难度: 中等查看答案及解析
-
一定温度下体积固定的密闭中的反应A(g)+3B(g)
2C(g),下列叙述不能表明该反应达到平衡状态的是
A. 容器中压强不再变化
B. C的消耗速率是A的消耗速率的2倍
C. 单位时间内生成amolA,同时消耗2amolC
D. B的体积分数不再变化
难度: 中等查看答案及解析
-
只改变一个影响因素,平衡常数K与平衡移动的关系叙述不正确的是
A.K值不变,平衡可能移动
B.平衡向右移动时,K值不一定移动
C.K值有变化,平衡一定移动
D.相同条件下,同一个反应的方程式的化学计量数增大2倍,K值也增大两倍
难度: 中等查看答案及解析
-
可逆反应mA(g)+nB(g)
pC(g)+qD(g)的v-t图象如左图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图:
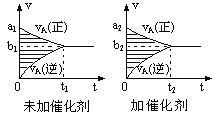
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是( )
A. ①④⑥⑧ B. ②④⑤⑦ C. ②③⑤⑧ D. ①③⑥⑦
难度: 中等查看答案及解析
-
将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应2SO2(g)+O2(g)
2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
A. 0.3 mol B. 0.15 mol
C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol
难度: 中等查看答案及解析
-
氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:则△H1、△H2、△H3的关系正确的是
4Al(s)+3O2(g)═2Al2O3(s)△H1①
4Al(s)+2O3(g)═2Al2O3(s)△H2②
3O2(g)═2O3(g)△H3③
A. △H1﹣△H2=△H3 B. △H1+△H2=△H3
C. △H2﹣△H1=△H3 D. △H1+△H2+△H3=0
难度: 简单查看答案及解析
-
已知25℃时,RSO4(s)+CO32-(aq)
RCO3(s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是
A. 向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RSO4沉淀
B. 将浓度均为6×10-6mol/L的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C. 25℃时,RSO4的Ksp约为4.9×10-5
D. 相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
难度: 中等查看答案及解析
-
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是
A. c(Na+)==c(CH3COO-)+c(CH3COOH)
B. c(H+)==c(CH3COO-)+c(OH一)
C. c(Na+) >c(CH3COO-)>c(OH-)>c(H+)
D. c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
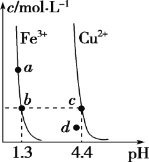
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. 在b、c两点代表的溶液中Fe(OH)3、Cu(OH)2分别达到饱和
难度: 中等查看答案及解析
-
下列各种情况下一定能大量共存的离子组为
A. pH=7的溶液中:Fe3+、Cl-、Na+、NO3-
B. 由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO32-、Cl-、K+
C. pH=1的溶液中:NH4+、Cl-、Cu2+、SO42-
D. 无色溶液中:Al3+、HCO3-、、I-、K+
难度: 中等查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
难度: 困难查看答案及解析