-
下列说法正确的是
A. 自发反应在任何条件下都能实现
B. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C. 常温下,氢氧化钡晶体与氯化铵晶体混合放出氨气,该反应为吸热反应
D. 同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的ΔH不同
难度: 中等查看答案及解析
-
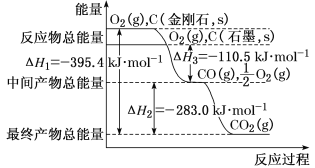
下列说法正确的是
A. 与同浓度的NaOH溶液反应时,稀硫酸中和热的绝对值是盐酸的两倍
B. 2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol,则CO的燃烧热为△H=-283kJ/mol
C. 中和热实验中,可以用铜棒代替易碎的环形玻璃搅拌棒
D. 中和热实验中,只需测反应的最终温度
难度: 中等查看答案及解析
-
某温度时,N2与H2反应过程中的能量变化如图所示。下列叙述正确的是
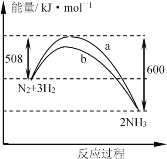
A. 正反应的活化能等于逆反应的活化能
B. a曲线是加入催化剂时的能量变化曲线
C. 1 mo N2与3 mo H2充分反应放出的热量小于92 kJ
D. 加入催化剂,该反应的焓变减小
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理来解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 红棕色的NO2,加压后颜色先变深后变浅
C. 含酚酞的氨水溶液,微热后红色变深
D. H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
难度: 中等查看答案及解析
-
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)(mol·L-1·min-1)表示,则正确的关系是
A. v(NH3)=2/3v(H2O) B. 5/6v(O2)=v(H2O)
C. 4/5v(NH3)=v(O2) D. v(O2)=4/5v(NO)
难度: 中等查看答案及解析
-
在给定环境中,下列各组离子可能大量共存的是
A. 澄清透明溶液中:Al3+、Fe3+、SO42-、Cl-
B. 甲基橙呈红色的溶液中:K+、Na+、S2-、AlO2-
C. 常温下,在c(H+)/ c(OH—)= 1×1012的溶液中:NH4+、CO32-、K+、Cl-
D. 常温下,水电离出的c(OH—)=1×10—13 mol/L的溶液中:Na+、NH4+、HCO3-、NO3-
难度: 中等查看答案及解析
-
对于反应:A+B
C ,下列条件的改变一定能使化学反应速率加快的是
A. 增加A的物质的量 B. 减少C的物质的量浓度
C. 增加体系的压强 D. 升高体系的温度
难度: 中等查看答案及解析
-
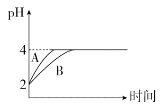
下列叙述正确的是
A. 室温下,0.2 mol·L-1的氨水与等体积水混合后pH=13
B. 某温度下,1L pH=6的纯水中含OH-为10-8mol
C. 通过测定0.01mol·L-1醋酸的pH,可验证CH3COOH是弱电解质
D. 为测定新制氯水的pH,用玻璃棒蘸取液体滴在湿润pH试纸上,与标准比色卡对照即可
难度: 中等查看答案及解析
-
在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O (l),示意图如下:
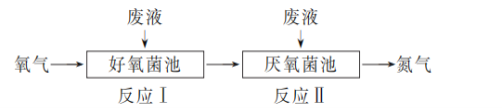
反应Ⅰ:NH4+(aq)+2O2(g)===NO3-(aq)+2H+(aq)+H2O (l) ΔH1=a kJ·mol-1
反应Ⅱ:5NH4+(aq)+3NO3-(aq)===4N2(g)+9H2O(l)+2H+(aq) ΔH2=b kJ·mol-1
下列说法正确的是
A. 两池发生的反应中,氮元素只被氧化
B. 两池中投放的废液体积相等时,NH4+能完全转化为N2
C. 常温常压下,反应Ⅱ中生成22.4 L N2转移的电子数为3.75×6.02×1023
D. 4NH4+(aq)+3O2(g)===2N2(g)+4H+(aq)+6H2O(l) ΔH=1/2(3a+b) kJ·mol-1
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是

A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率等于b点
D. 图4表示同一温度下,相同物质的量BaO2在不同容积的容器中进行反应:2BaO2(s)
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
难度: 中等查看答案及解析
-
高温下,某反应达平衡,平衡常数K=
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为正值
B. 恒温恒容下,通入N2,压强增大,反应速率加快
C. 升高温度,正反应速率加快,逆反应速率减慢,平衡正向移动
D. 该反应化学方程式为CO+H2O
CO2+H2
难度: 中等查看答案及解析
-
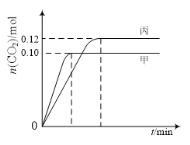
一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
容器
温度/℃
起始物质的量/mol
NO (g)
CO (g)
甲
T1
0.20
0.20
乙
T1
0.30
0.30
丙
T2
0.20
0.20
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%
难度: 中等查看答案及解析