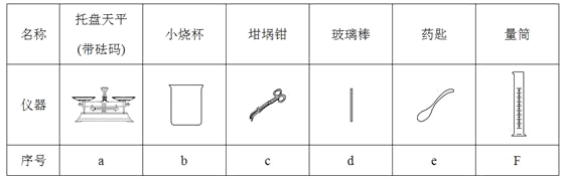
-
已知化学反应A2(g) + B2(g) ="==" 2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
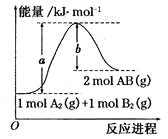
A.每生成2分子AB吸收bkJ热量
A. 该反应热△H=+(a-b)kJ/mol
B. 该反应中反应物的总能量高于生成物的总能量
C. 断裂1molA—A和1molB—B键,放出akJ能量
难度: 中等查看答案及解析
-
已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,由此判断下列热化学方程式书写正确的是( )
A. KOH(aq)+
H2SO4(浓)===
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
B.
Ba(OH)2(aq)+
H2SO4(aq)===
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C. HCN(aq)+KOH(aq)=== KCN(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
D. HCl(aq)+NaOH(aq)=== NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
难度: 简单查看答案及解析
-
已知:P4(g)+6Cl2(g)
4PCl3(g) ΔH=akJ·mol-1,P4(g)+10Cl2(g)
4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构(如图),PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
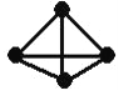
A. P—P键的键能大于P—Cl键的键能
B. 可求Cl2(g)+PCl3(g)
PCl5(s)的反应热ΔH
C. Cl—Cl键的键能为0.25(b﹣a+5.6c) kJ·mol-1
D. P—P键的键能为0.125(5a﹣3b +12c)kJ·mol-1
难度: 困难查看答案及解析
-
符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3
⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
难度: 中等查看答案及解析
-
已知:2H2(g)+ O2(g)=2H2O(l) ΔH=-571.6KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH=-890KJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1∶1 B.1∶3 C.1∶4 D.2∶3
难度: 中等查看答案及解析
-
在一定温度下,10 mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。

下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平衡反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B. 6~10 min的平衡反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C. 反应到6 min时,c(H2O2)=0.30 mol·L-1
D. 反应到6 min时,H2O2分解了50%
难度: 困难查看答案及解析
-
工业上利用可逆反应N2(g)+3H2(g)
2NH3(g)合成氨,下列叙述正确的是
A. 合成氨的适宜条件是高温、高压、催化剂,其中催化剂不改变该反应的逆反应速率
B. 恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=(c2-c1)/(t2-t1)
难度: 中等查看答案及解析
-
工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g)
CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
A. 单位时间内消耗2 mol的CO同时生成2 mol的CO2
B. 两个H—O键断裂的同时有一个H—H键断裂
C. 反应容器内的压强不再发生变化
D. 混合气体的相对分子质量不发生变化
难度: 困难查看答案及解析
-
已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:
2CrO42-(黄色)+2H+
Cr2O72-(橙色)+H2O
若要使溶液的橙色加深,下列可采用的方法是
A.加入适量稀盐酸 B.加入适量稀硝酸
C.加入适量烧碱固体 D.加水稀释
难度: 简单查看答案及解析
-
由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )
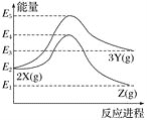
A. 由 X→Z 反应的 ΔH<0
B. 由 X→Y 反应的 ΔH=E5-E2
C. 增大压强有利于提高 Y 的产率
D. 升高温度有利于提高 Z 的产率
难度: 中等查看答案及解析
-
在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g)
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
C. 在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆
D. 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
难度: 困难查看答案及解析
-
利用I2O5可消除CO污染,其反应为:反应为I2O5(s)+5CO(g)
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( )
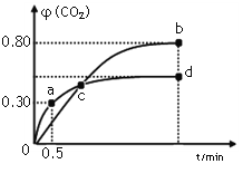
A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. 0到0.5 min反应速率v(CO)=0.3 mol·L-1·min-1
难度: 困难查看答案及解析
-
已知:CO(g)+H2O(g)
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
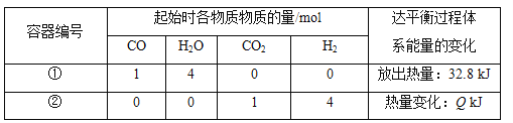
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率
难度: 困难查看答案及解析
-
可逆反应N2(g)+3H2(g)
2NH3(g),在容积为10 L的密闭容器中进行,开始时加入2 mol N2和3 mol H2,则达到平衡时,NH3的浓度不可能为( )
A. 0.1 mol·L-1 B. 0.2 mol·L-1 C. 0.05 mol·L-1 D. 0.15 mol·L-1
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A. SO2(g)+H2O(g)===H2SO3(l),该过程熵值增大
B. SO2(g) ===S(s)+O2(g) ΔH>0,ΔS<0该反应能自发进行
C. SO2(g)+2H2S(g)===3S(s)+2H2O(l) ,该过程熵值增大
D. Ba(OH)2(s)+2NH4Cl(s)===2BaCl2(s)+2NH3(g)+2H2O(l),ΔH<0,此反应一定能自发
难度: 中等查看答案及解析