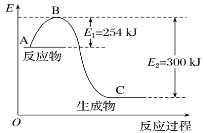
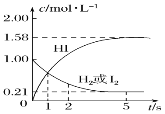
-
短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
W
X
Y
Z
A. 氢化物沸点:W > Z B. 氧化物对应水化物的酸性:Y > W
C. 化合物熔点:Y2X3 < YZ3 D. 简单离子的半径:Y < X
难度: 困难查看答案及解析
-
2016年IUPAC命名117号元素为Ts(中文名“
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱 D. 中子数为176的Ts核素符号是
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 金刚石中碳原子杂化类型为sp2
B. 12g石墨中含有2NA个六元环
C. SiO2晶体中最小环为6元环
D. CaF2晶体是离子晶体,阴阳离子配位数之比为1:2
难度: 中等查看答案及解析
-
已知:CO(g)+H2O(g)
CO2(g)+H2(g) △H=-41kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号
起始时各物质的物质的量/mol
达平衡过程体系的能量变化
CO
H2O
CO2
H2
①
1
4
0
0
放出热量:32.8kJ
②
0
0
1
4
热量变化:Q
下列说法中,不正确的是
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 容器①中CO反应速率等于H2O的反应速率
D. 平衡时,两容器中CO2的浓度相等
难度: 中等查看答案及解析
-
已知25 ℃、101 kPa下,碳、氢气、乙烯和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、1 411.0 kJ·mol-1、2 800 kJ·mol-1,则热化学方程式正确的是( )
A. C(s)+1/2O2(g)===CO(g) ΔH=-393.5 kJ·mol-1
B. 2H2(g)+O2(g)===2H2O(g) ΔH=+571.6 kJ·mol-1
C. C2H4(g)+3O2(g)===2CO2(g)+2H2O(g) ΔH=-1 411.0 kJ·mol-1
D. 1/2 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
难度: 简单查看答案及解析
-
一定温度下反应N2+O2
2NO在密闭容器中进行,下列措施不改变化学反应速率的是
A. 缩小体积使压强增大 B. 恒容,充入N2
C. 恒容,充入He D. 恒压,充入He
难度: 中等查看答案及解析
-
在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g) ⇌ pC(g)+qQ(g) (m、n、p、q为任意整数)一定达到平衡时的标志是( )
①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率vA∶vB∶vC∶vQ=m∶n∶p∶q ⑥单位时间内m mol A断键的同时有p mol C也断键
A. ③④⑤⑥ B. ①③④⑤ C. ②③④⑥ D. ①③④⑥
难度: 中等查看答案及解析
-
下列事实能用勒夏特列原理解释的是( )
A. 加入催化剂有利于合成氨的反应
B. 由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深
C. 500 ℃时比室温更有利于合成氨的反应
D. 将混合气体中的氨液化有利于合成氨反应
难度: 中等查看答案及解析
-
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)
pC(g)的速率和平衡的影响图象如下,下列判断正确的是
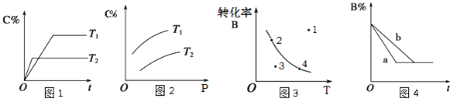
A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n<p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
难度: 中等查看答案及解析
-
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃
25
80
230
平衡常数
5×104
2
1.9×10-5
下列说法不正确的是( )
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为2×10-5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正>v逆
D. 在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
难度: 简单查看答案及解析