-
下列物质的分类正确的是 ( )
碱
酸
盐
碱性氧化物
酸性氧化物
A
Na2CO3
H2SO4
Cu2(OH)2CO3
Fe2O3
SO3
B
NaOH
HCl
NaCl
Na2O
NO2
C
NaOH
NaHSO4
CaF2
MgO
SO2
D
KOH
HNO3
NaHCO3
CaO
Mn2O7
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的个数有
①盐卤点豆腐、江河入海口处“三角洲”的形成、高压直流电除烟尘均与胶体的性质有关
②通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
③氢氧化铁胶体能稳定存在的主要原因是胶体粒子做布朗运动
④做氢氧化铁胶体电泳实验时,阴极周围红褐色加深,说明氢氧化铁胶体带正电
⑤向FeCl3溶液中滴加NaOH溶液,可制得Fe(OH)3胶体
⑥1mol FeCl3完全与水反应生成氢氧化铁胶体粒子数约为NA个
⑦淀粉溶液和蛋白质溶液是溶液,不可能是胶体
A. 1个 B. 2个 C. 3个 D. 4个
难度: 中等查看答案及解析
-
现有反应的化学方程式为aFeCl2+bKNO3+ cHCl=d FeCl3+eKCl+f X+gH2O。若b=1,d=3,X为生成物,其分子式应为 ( )
A. NH4Cl B. NO2 C. NO D. N2
难度: 中等查看答案及解析
-
化学是一门以实验为基础的科学,下列说法正确的一组是
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热
③将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
④将烧瓶放在桌上,用力塞紧塞子
⑤进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
⑥向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32-
⑦用坩埚钳夹取加热后的蒸发皿
⑧将溶质的质量分数为a%、物质的量浓度为c1 mol•L-1的稀硫酸加热蒸发掉一定量水,使溶质的质量分数变为2a%,则此时硫酸的物质的量浓度大于2c1 mol•L-1。
A. ②③⑥⑦⑧ B. ①③④⑦ C. ①③⑦⑧ D. ①③⑤⑥⑦
难度: 中等查看答案及解析
-
在“粗盐提纯”的溶解、过滤、蒸发等实验步骤中,使用次数最多的仪器是
A. 烧杯 B. 托盘天平 C. 玻璃棒 D. 漏斗
难度: 简单查看答案及解析
-
某无色溶液含有下列离子中的若干种:H+、NH4+、Cu2+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下列物质贴错了包装标签的是( )
A. 浓硫酸
 B. 汽油
B. 汽油  C. 酒精
C. 酒精  D. 氯化钾
D. 氯化钾
难度: 中等查看答案及解析
-
日常生活中,许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是
A. 铜质奖章上出现铜绿[Cu2(OH)2CO3]
B. 充有H2的“喜羊羊”娃娃遇明火发生爆炸
C. 大理石雕像被酸雨腐蚀毁坏
D. 轮船底部生锈
难度: 中等查看答案及解析
-
下列实验现象描述错误的是
编号
实验
现象
A
加热放在坩埚中的小块钠
钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体
B
在酒精灯上加热用砂纸打磨过的铝箔
铝箔变软,失去光泽,熔化的铝并不滴落
C
在FeCl3溶液中加入Na
钠浮在液面上,熔化成小球,小球迅速游动,并发出嘶嘶的响声,同时生成红褐色沉淀
D
将水蒸气通过灼热的铁粉
黑色粉末变为红褐色
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
钠与水反应时产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动,逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。其中正确的一组是
A. ①③④⑤⑥ B. ①②③④⑤ C. ①②③⑥ D. 全部
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 氢氧化钡溶液加入稀硫酸中:Ba2++OH-+H++SO42-===BaSO4↓+H2O
B. 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O
C. 石灰石上滴加稀醋酸:CaCO3 + 2H+═ Ca2+ + H2O + CO2↑
D. 铜片插入硝酸银溶液中:Cu + Ag+ ═ Cu2+ + Ag
难度: 简单查看答案及解析
-
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项
A
B
C
D
实验
用CCl4提取溴水中的Br2
从食盐水中提取NaCl固体
从KI和I2的固体混合物中回收I2
配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液
装置或仪器

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某溶液中所含离子的浓度如下表,则a值为
离子
NO3-
SO42-
H+
Mg2+
K+
浓度(mol/L)
0.3
0.4
0.2
0.2
a
A. 0.1 B. 0.3 C. 0.5 D. 0.7
难度: 简单查看答案及解析
-
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O
2HI+H2SO4
②2FeCl3+2HI
2FeCl2+2HCl+I2
③3FeCl2+4HNO3
2FeCl+NO+2H2O+Fe(NO3)3
A. H2SO3>I->Fe2+>NO B. I->Fe2+>H2SO3>NO C. Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3>I-
难度: 中等查看答案及解析
-
在溶液中能大量共存,加入NaOH溶液后有沉淀产生,加入盐酸后有气体放出的是
A. Na+、Cu2+、Cl-、S2- B. Fe3+、K+、SO42-、NO3-
C. Na+、SiO32-、OH-、NO3- D. Na+、Ba2+、Cl-、HCO3-
难度: 简单查看答案及解析
-
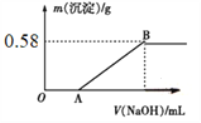
用0.1mol/l的Na2SO3溶液40mL,恰好将0.002mol的X2O42-还原,Na2SO3被氧化成Na2SO4 则元素X在还原产物中的化合价是( )
A. +1 B. +2 C. +3 D. +4
难度: 简单查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )。
A. 生成42.0 L N2(标准状况)
B. 有0.250 mol KNO3被氧化
C. 转移电子的物质的量为1.25 mol
D. 被氧化的N原子的物质的量为1.875 mol
难度: 困难查看答案及解析
-
如图所示,室温下的两个连通容器用活塞分开,左右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,反应如下:2NO+O2=2NO2。下列判断正确的是(不考虑NO2转化为N2O4) ( )
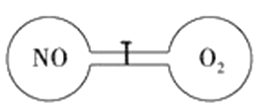
A. 反应前后左室的压强相同
B. 开始时左右两室中的分子数相同
C. 反应后容器内的密度与反应前的相同
D. 反应后容器内无O2存在
难度: 困难查看答案及解析
-
甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是( )
A. 参加反应的H2SO4为0.2mol B. 参加反应的NaOH约为0.27mol
C. 加入铝粉的质量A=5.4 D. 与硫酸反应的铝粉的质量7.2g
难度: 中等查看答案及解析
-
下图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试根据图判断M气体可能是
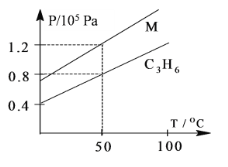
A. C3H4 B. CO2 C. CO D. H2S
难度: 中等查看答案及解析