-
化学关系着我们的生活,我们的未来。下列说法正确的是
A. 石墨烯(由碳原子构成的六角形蜂巢晶格)材料属于一种新型化合物
B. 可从海水中提取氯化镁,使氯化镁分解获得镁并释放能量
C. 推广用原电池原理制成的太阳能电池汽车,可减少化石能源的使用
D. 采煤工业爆破时把干冰和炸药放在一起,既能增强爆炸威力又能预防火灾
难度: 简单查看答案及解析
-
下列说法正确的是
A. 光导纤维可用作通讯材料是因为其有导电性
B. 氧化性:HC1O>稀H2SO4,故非金属性:C1>S
C. 把饱和FeCl3溶液煮沸至红褐色,可制得氢氧化铁胶体
D. 采取“燃煤固硫”、“汽车尾气催化净化”等方法,可减少空气污染
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列粒子数目为0.2NA的是
A. 常温常压下,3.1 g P4分子中所含P—P键数目
B. 铁作阳极进行电解时,5.6g铁放电时转移的电子数目
C. 各取0.1mol铜分别与足量氯气、硫反应,转移电子数目
D. 3.9gNa2O2与H2O反应后制成500mL溶液,溶液中的Na+数目
难度: 简单查看答案及解析
-
在前一种分散系中缓慢滴加后一种试剂,能观察到先沉淀后变澄清的是
①向氯化铝溶液中滴加氢氧化钠溶液 ②向氢氧化钠溶液中滴加氯化铝溶液
③向水玻璃中滴加盐酸 ④向硝酸银溶液中滴加氨水
⑤向氢氧化铁胶体中滴加硫酸
A. ①③⑤ B. ②③⑤ C. ①④⑤ D. ②④⑤
难度: 中等查看答案及解析
-
下列说法正确的
A. 能通过化合反应和复分解反应来制取Fe(OH)3
B. 物质中所含元素显最高价时一定表现出强氧化性
C. 含等浓度Cu2+、Fe3+的混合液中加少量铁粉,Cu2+先得电子
D. 电解精炼铜转移0.2mol电子时,阴极析出铜的质量一定小于6.4g
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 向碘化钾溶液中加入硫酸酸化的过氧化氢溶液:2I-+H2O2===I2+2OH-
B. 向碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++OH-===NH3·H2O
C. 磷酸与氢氧化钠发生中和反应:H3PO4+3OH-===PO43-+3H2O
D. 氧化铁溶于过量的氢碘酸中:Fe2O3+6H+===2Fe3++2H2O
难度: 中等查看答案及解析
-
下列有关实验操作正确的是
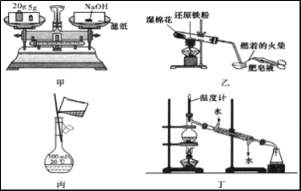
A. 甲:称量25.0g氢氧化钠固体
B. 乙:检验铁粉与水蒸气反应产生的氢气
C. 丙:配制100mL 1.0 mol·L-1氢氟酸溶液时的转移操作
D. 丁:分离两种互溶且沸点相差较大的液态物质
难度: 简单查看答案及解析
-
A、B、C、D、E为原子序数依次递增的短周期主族元素。A的气态氢化物与其最高价氧化物对应的水化物可反应形成盐,B原子最外层电子数是内层电子数的3倍,C的原子半径是本周期最大的,D的单质为淡黄色固体。下列说法不正确的是
A. 简单气态氢化物的稳定性:B>A
B. 物质CAB2有毒,不能用作食品添加剂
C. 最高价氧化物对应的水化物酸性:E>D
D. B、C、E以原子个数比1:1:1的形成的化合物可用于杀菌消毒
难度: 简单查看答案及解析
-
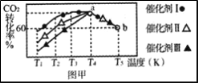
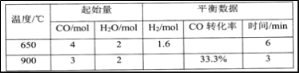
下列有关物质转化关系的说法中不正确的是
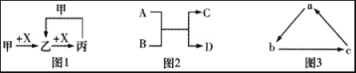
A. 图1中甲可能是Fe,X可能是Cl2
B. 图2中A可能为F2,C可能为O2
C. 图2中A可能为Ca(OH)2,C可能为NaOH
D. 图3中a可能为C,b可能为CO,c可能为CO2
难度: 中等查看答案及解析
-
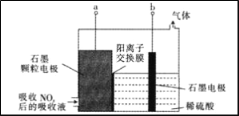
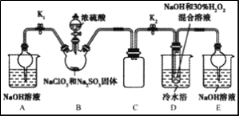
室温下,某兴趣小组用下图所示装置在通风橱中进行如下实验:

下列说法不正确的是
A. 试管II中红棕色气体为NO2,由硝酸还原生成
B. 等质量的Cu完全溶解时,II试管中消耗的HNO3多
C. 将Cu换成Fe之后重复实验,依然是试管II中反应更剧烈
D. 试管II中反应后溶液颜色与试管I中的不同,是由于溶有NO2
难度: 简单查看答案及解析
-
由下列实验操作和现象可得出结论正确的是
选项
实验操作
实验现象
结论
A
向Co2O3中滴入浓盐酸
产生黄绿色气体
氧化性:Cl2>Co2O3
B
向铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液
无明显现象
该过程未发生氧化环氧反应
C
向硫化钠溶液中滴加盐酸
产生臭鸡蛋气味气体
非金属性:Cl>S
D
将10mL 2mol/L的碘化钾溶液与1mL 1mol/L FeCl3 溶液充分反应后滴加KSCN溶液
溶液颜色变红
K与FeCl3反应有可逆性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
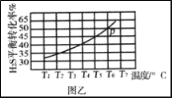
已知:。向体积可变的密闭容器中充入一定量的CH4(g)和O2(g)发生反应,CH4(g)的平衡转化率与温度(T)和压强(p)的关系如下图所示(已知T1>T2)。
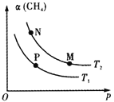
下列说法正确的是
A. 该反应的△H>0
B. M、N两点的H2的物质的量浓度:c(M)>c(N)
C. 温度不变时,增大压强可由N点到P点
D. N、P两点的平衡常数:K(N)<K(P)
难度: 困难查看答案及解析
-
锌溴液流电池用溴化锌溶液作电解液,并在电池间不断循环。下列有关说法正确的是
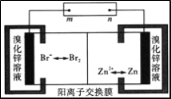
A. 充电时阴极的电极反应式为Br2+2e-===2Br-
B. 充电时n接电源的正极,Zn2+通过阳离子交换膜由左侧流向右侧
C. 放电时阳离子交换膜的左侧溶液中离子浓度增大
D. 放电时每转移2 mol电子负极区溶液质量减少65g
难度: 中等查看答案及解析
-
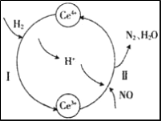
在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(1),示意图如下:
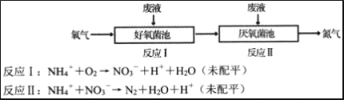
下列说法正确的是
A. 两池发生的反应中,氮元素只被氧化
B. 常温常压下,反应II中生成8.96 L N2时,转移电子数为1.5NA
C. 好氧菌池与厌氧菌池投入废液的体积之比为3:5时,NH4+能完全转化为N2
D. 反应Ⅱ中氧化剂与还原剂物质的量之比为5:3
难度: 困难查看答案及解析