-
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如针,尖长者为胜,平短者次之”,文中涉及的操作方法是
A. 萃取 B. 蒸馏 C. 干馏 D. 升华
难度: 中等查看答案及解析
-
四种短周期元素W、X、Y、Z的原子序数依次增大,W元素的最外层电子数是其电子层数的二倍;X的原子半径是短周期主族元素原子中最大的;Y是地壳中含量最多的金属元素;X与Z形成的离子化合物的水溶液呈中性。下列叙述中,不正确的是
A. 将W的最高价氧化物通入到Na2SiO3溶液中,生成白色沉淀,得出非金属性:W>Si
B. 将X单质投入到CuSO4溶液中,生成紫红色固体
C. 工业上用电解熔融Y的氧化物的方法冶炼金属Y
D. Z的气态氢化物的沸点在同主族中最低
难度: 中等查看答案及解析
-
厉害了我的国!“中国名片”中航天、军事、天文等领域的发展受到世界瞩目,它们与化学有着密切联系。下列说法正确的是
A. “中国天眼”的“眼眶”是钢铁结成的圈梁,属于新型无机非金属材料
B. “歼−20”飞机上大量使用的碳纤维是一种新型有机高分子材料
C. “神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料
D. “天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. SO2具有氧化性,常用于漂白秸秆、织物
B. 明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂
C. 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
D. 次氯酸有酸性,可用于自来水的杀菌消毒
难度: 简单查看答案及解析
-
下列家庭化学实验不能达到预期目的的是
A. 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
B. 用湿润的淀粉-KI 试纸检验 HCl气体中是否混有 Cl2
C. 向 Ca(ClO)2 溶液中加入硫酸溶液,来证明 S、Cl 的非金属性强弱
D. 将一片铝箔用火灼烧,铝箔熔化但不滴落,证明铝箔表面致密Al2O3薄膜熔点高于Al
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 常温常压下, 30 g乙烷中所含的极性共价键数为6NA
B. 0.2mol N2和0.6mol H2混合充分反应后,转移的电子数目为1.2 NA
C. 0.1 mol9038Sr原子中含中子数为3.8NA
D. 0.1 mol·L-1的NH4NO3溶液中含有的氮原子数为0.2 NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A. 氢氧化铁胶体中加入HI溶液:Fe(OH)3+3H+═Fe3++3H2O
B. 用氨水溶解氢氧化铜沉淀:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O
C. 用稀硝酸除去试管内壁银:3Ag+4H++NO3﹣═3Ag++NO↑+2H2O
D. 向NaClO溶液中通入过量的SO2:SO2+NaClO+H2O=HClO+NaHSO3
难度: 中等查看答案及解析
-
如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
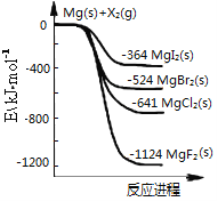
A. 卤素单质(X2)与水反应均可生成两种酸
B. MgF2的电子式为:
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g) ΔH=-277 kJ·mol-1
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是
A. c(OH−)/c(H+)=1×1014的溶液中:K+、Na+、I−、SiO32-
B. 水电离出的c( H+)= 1× 10-13 mol·L-1的溶液中:Ca2+、Ba2+、Cl-、HCO3-
C. 加入铝粉能放出氢气的溶液中:Ba2+、Cl-、Fe3+、NO3-
D. c(SO32-)=0.1 mol·L-1的溶液中:Ca2+、MnO4-、SO42-、H+
难度: 中等查看答案及解析
-
下列实验操作正确的是
A. 制备无水氯化铁
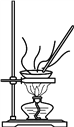
B. 配制一定浓度的硫酸溶液
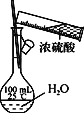
C. 制取少量NH3

D. 比较NaHCO3和Na2CO3的热稳定性
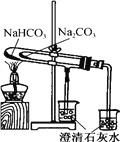
难度: 中等查看答案及解析
-
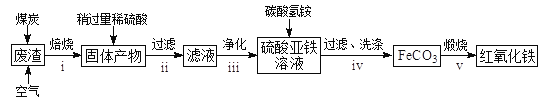
向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜。其反应过程如图所示。

下列说法不正确的是
A. Fe3+对该反应有催化作用
B. 该过程中的Fe3+可由Fe(NO3)3提供
C. 可用K3[Fe(CN)6]溶液区分Fe3+与Fe2+
D. 制备CuCl2的总反应为2Cu + O2 + 4HCl = 2CuCl2 + 2H2O
难度: 中等查看答案及解析
-
某同学为测定Na2CO3固体(含少量NaC1)的纯度,设计如下装置(含试剂)进行实验。
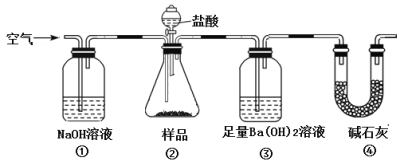
下列说法不正确的是
A. 必须在②③间添加吸收HC1的装置
B. ④的作用是防止空气中的气体影响实验的精确度
C. 反应后通入空气的作用是保证②中产生的气体完全转移到③中
D. 根据称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
难度: 中等查看答案及解析
-
下列实验叙述错误的是
A. 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,说明原溶液中有Na+而无法判断是否有K+
B. 配制硫酸铁溶液时,将硫酸铁溶解在硫酸中,再加水稀释
C. 中和滴定时,滴定管用蒸馏水洗涤2~3次后即可加入标准溶液进行滴定
D. 向某钠盐 X 的溶液中先滴加稀盐酸,无现象,再滴加 BaCl2 溶液,出现白色沉淀,X 不一定是Na2SO4
难度: 中等查看答案及解析
-
在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O (l),示意图如下:
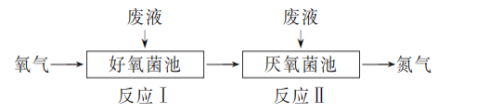
反应Ⅰ:NH4+(aq)+2O2(g)===NO3-(aq)+2H+(aq)+H2O (l) ΔH1=a kJ·mol-1
反应Ⅱ:5NH4+(aq)+3NO3-(aq)===4N2(g)+9H2O(l)+2H+(aq) ΔH2=b kJ·mol-1
下列说法正确的是
A. 两池发生的反应中,氮元素只被氧化
B. 两池中投放的废液体积相等时,NH4+能完全转化为N2
C. 常温常压下,反应Ⅱ中生成22.4 L N2转移的电子数为3.75×6.02×1023
D. 4NH4+(aq)+3O2(g)===2N2(g)+4H+(aq)+6H2O(l) ΔH=1/2(3a+b) kJ·mol-1
难度: 中等查看答案及解析
-
锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
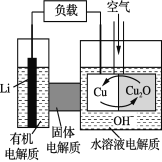
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
难度: 中等查看答案及解析
-
研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列判断中正确的是
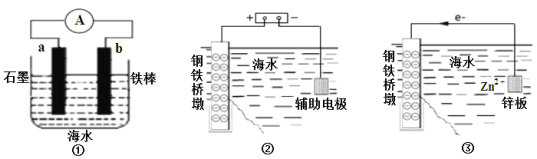
A. 用装置①模拟研究时未见a上有气泡产生,说明铁棒没有被腐蚀
B. ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C. ③中采用了牺牲阳极的阴极保护法保护桥墩
D. ①②③中海水均是实现化学能转化为电能的电解质
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
将SO2气体通入Ba(NO3)2溶液
有白色沉淀
SO2中混有SO3
B
向NaAlO2溶液中持续通入气体Y
先出现白色沉淀,最终沉淀又溶解
Y可能是CO2气体
C
AgCl悬浊液中滴入少量Na2S溶液
沉淀变黑色
Ksp(Ag2S)>Ksp(AgCl)
D
向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液
前者溶液变蓝色,后者有黄色沉淀
KI3溶液中存在平衡:
I3-
I2+I-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
全钒氧化还原电池是一种新型可充电电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+- e-=V3+,下列说法正确的是
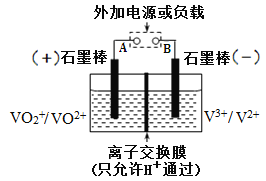
A. 放电时,右槽发生还原反应
B. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C. 充电时,每转移1mol电子,n(H+)的变化量为1mol
D. 充电时,阴极电解液pH升高
难度: 中等查看答案及解析
-
已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3
H2SO3
HClO
K1=4.30×10-7
K1=1.54×10-2
K=2.95×10-8
K2=5.61×10-11
K2=1.02×10-7
下列说法正确的是
A. 相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B. Na2CO3溶液中通入少量SO2: 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO 溶液中通入少量CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. 向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度
难度: 困难查看答案及解析
-
实验小组进行如下实验:
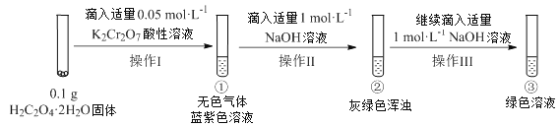
已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。
下列关于该实验的结论或叙述不正确的是
A. ①中生成蓝紫色溶液说明K2Cr2O7在反应中表现了氧化性
B. 若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
C. 将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
D. 操作I中产生的无色气体是CO
难度: 中等查看答案及解析
-
硼酸(H3BO3) 为一元弱酸,H3BO3可以通过电解的方法制备。其工作原理如下图所示( 阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
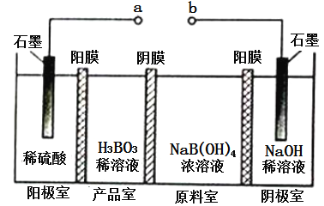
A. a 与电源的正极相连接
B. 阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C. [B(OH)4]-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
D. 当电路中通过3mol 电子时,可得到1molH3BO3
难度: 困难查看答案及解析